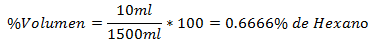Exemplu de concentrare: molaritate, molalitate, normalitate și procentaj
Chimie / / July 04, 2021
Concentraţie este definit ca Cantitatea sau proporția unei anumite substanțe, prezentă într-o soluție. Soluția este o amestec omogen (monofazat vizibil) care poate fi solid, lichid sau gazos, deci Concentrația poate fi exprimată în moduri diferite.
Este necesar să se definească faptul că o Soluție conține două componente principale: Solut și solventși, în general, Concentrarea se concentrează pe exprimarea cantității de Solut amestecat în Soluția Întregă. Însă Concentrația poate exprima cantitatea sau proporția oricăreia dintre ele.
Exprimarea concentrării
În chimie, cantitatea de substanță prezentă într-o soluție poate fi exprimată în mai multe moduri diferite: Molaritate, Molalitate, Normalitate, Procentaj în greutate, Procentaj în volum.
Dintre aceste cinci unități, toate pot fi aplicate soluțiilor solide, lichide și gazoase. Dar, de exemplu, Molalitatea este cea care este utilizată cel mai mult pentru soluții solide.
Exemple de molaritate
Molaritatea indică câte moli de substanță sunt în fiecare litru de soluție completă
. Este cea mai utilizată unitate în chimie pentru soluții lichide, atunci când se face analize volumetrice. Este indicat de litera „M”.Cunoscând grame de soluție, acestea sunt împărțite la greutatea moleculară a soluției. Astfel, se obțin molele de solut prezente în soluție.
Apoi, alunitele de solut sunt împărțite la litrii de soluție, și astfel se obțin unitățile de molaritate: alunecii de solut / litru de dizolvare.
1.- Pentru o soluție de 0,5 litri de hidroxid de magneziu [Mg (OH)2], iar dacă greutatea moleculară a hidroxidului de magneziu este de 58 g / mol. Aveți 36 de grame.
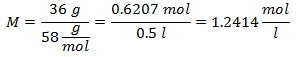
2.- Pentru o soluție de 1 litru de hidroxid de calciu [Ca (OH)2], iar dacă greutatea moleculară a hidroxidului de calciu este de 74 g / mol. Aveți 42 de grame.

3.- Pentru o soluție de 3 litri de clorură de sodiu (NaCl), iar dacă greutatea moleculară a clorurii de sodiu este de 58 g / mol. Aveți 28 de grame.
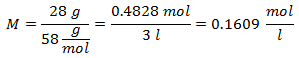
4.- Pentru o soluție de 5 litri de clorură de calciu (CaCl2), iar dacă greutatea moleculară a clorurii de calciu este de 110 g / mol. Aveți 13 grame.
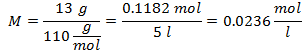
5.- Pentru o soluție de 10 litri de sulfat de sodiu (Na2SW4), iar dacă greutatea moleculară a sulfatului de sodiu este de 142 g / mol. Aveți 96 de grame.
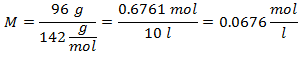
Exemple de Molalitate
Molalitatea indică câte moli de Solut sunt la 1000 de grame de Solvent în Soluție. Este cea mai utilizată unitate în chimie pentru soluții solide. Este indicat de litera „m”.
Cunoscând grame de soluție, acestea sunt împărțite la greutatea moleculară a soluției. Astfel, se obțin molele de solut prezente în soluție.
Apoi, Moles of Solute sunt ajustate pentru fiecare 1000 de grame de Soluție, care sunt stabilite ca bază de calcul și astfel se obțin unitățile de molalitate: Moli de solut / 1000g de Solvent
1.- Pentru o soluție cu 1000 g de solvent mineral și 36 de grame de hidroxid de magneziu [Mg (OH)2], iar dacă greutatea moleculară a hidroxidului de magneziu este de 58 g / mol.

2.- Pentru o soluție de 2000g solvent mineral și 42 grame de hidroxid de calciu [Ca (OH)2], iar dacă greutatea moleculară a hidroxidului de calciu este de 74 g / mol.
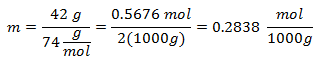
3.- Pentru o soluție de 3000 g de solvent mineral și 28 de grame de clorură de sodiu (NaCl), iar dacă greutatea moleculară a clorurii de sodiu este de 58 g / mol.
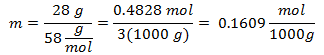
4.- Pentru o soluție de 5000g solvent mineral și 13 grame de clorură de calciu (CaCl2), iar dacă greutatea moleculară a clorurii de calciu este de 110 g / mol.
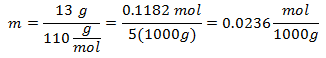
5.- Pentru o soluție de 10.000 g de solvent mineral și 96 de grame de sulfat de sodiu (Na2SW4), iar dacă greutatea moleculară a sulfatului de sodiu este de 142 g / mol.
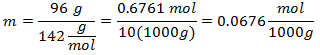
Cantitățile de solvenți sunt tratate ca multipli de 1000g, pentru a lăsa 1000 de grame ca referință și a nu le include, afectând calculul.
Exemple de normalitate
Normalitatea indică câte substanțe echivalente sunt în fiecare litru de soluție completă. Normalitatea este cealaltă unitate cea mai utilizată în chimie pentru soluțiile lichide, atunci când se face analiza volumetrică. Este indicat de litera „N”.
Un echivalent este o unitate care rezultă din împărțirea gramei soluției (g) la greutatea sa echivalentă (mică). Greutatea echivalentă (Peq) rezultă din împărțirea greutății moleculare (PM) la Valencia activă (*), care este mai ușor de observat în acizi și baze. De exemplu, Valencia activă a acidului clorhidric (HCI) este 1; Valencia activă a hidroxidului de calciu [Ca (OH)2] este 2, datorită ionilor de hidrogen (H +) și hidroxil (OH-) pe care îi prezintă fiecare.
Apoi, echivalenții soluti sunt împărțiți la litrii de soluție și astfel se obțin unitățile de normalitate: echivalenții soluti / litru de soluție
1.- Pentru o soluție de 0,5 litri de hidroxid de magneziu [Mg (OH)2], iar dacă greutatea moleculară a hidroxidului de magneziu este de 58 g / mol. Aveți 36 de grame.
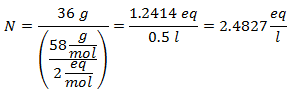
2.- Pentru o soluție de 1 litru de hidroxid de calciu [Ca (OH)2], iar dacă greutatea moleculară a hidroxidului de calciu este de 74 g / mol. Aveți 42 de grame.
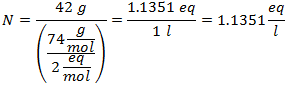
3.- Pentru o soluție de 3 litri de clorură de sodiu (NaCl), iar dacă greutatea moleculară a clorurii de sodiu este de 58 g / mol. Aveți 28 de grame.
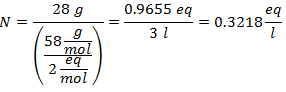
4.- Pentru o soluție de 5 litri de clorură de calciu (CaCl2), iar dacă greutatea moleculară a clorurii de calciu este de 110 g / mol. Aveți 13 grame.
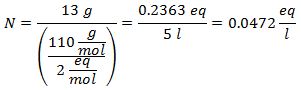
5.- Pentru o soluție de 10 litri de sulfat de sodiu (Na2SW4), iar dacă greutatea moleculară a sulfatului de sodiu este de 142 g / mol. Aveți 96 de grame.
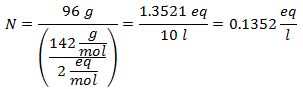
Exemple de procentaj în greutate
Procentaj în greutate este o expresie a concentrării care rezultă din împărțirea Cantitate în grame de soluție între grame de soluție totală. Obținând o cantitate zecimală, aceasta se înmulțește cu 100 și se exprimă cu simbolul „%”. Această unitate este în general utilizată pentru măsurarea concentrațiilor în amestecuri solide sau granulare.
1.- Un amestec de 1300 g în total conține 13 g de carbonat de calciu. Procentul în greutate este:
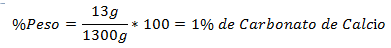
2.- Un amestec de 100g total conține 26g de zahăr. Procentul în greutate este:
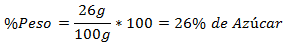
3.- Un amestec de 250g total conține 60g clorură de sodiu. Procentul în greutate este:
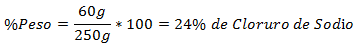
4.- Un amestec de 800g total conține 150g de hidroxid de calciu. Procentul în greutate este:
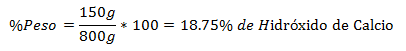
5.- Un amestec de 1500g în total conține 10g de bicarbonat de sodiu. Procentul în greutate este:
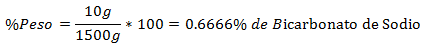
Exemple de procentaj de volum
Procentaj în volum este o expresie a concentrării care rezultă din împărțirea cantitatea în unități de volum a soluției împărțită la volumul soluției totale. Obținând o cantitate zecimală, aceasta se înmulțește cu 100 și se exprimă cu simbolul „%”. Această unitate este în general utilizată pentru măsurarea concentrațiilor în amestecuri de componente lichide sau gazoase.
1.- Un amestec de 1300 ml în total conține 130 ml de etanol. Procentul de volum este:
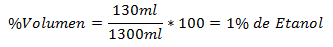
2.- Un amestec de 100 ml total conține 26 ml de glicerină. Procentul de volum este:
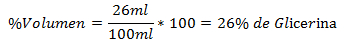
3.- Un amestec de 250 ml total conține 60 ml eter etilic. Procentul de volum este:
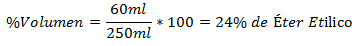
4.- Un amestec de 800 ml în total conține 150 ml de glicol. Procentul de volum este:
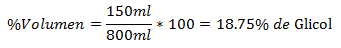
5.- Un amestec de 1500 ml în total conține 10 ml de hexan. Procentul de volum este: