Exemplu de energie chimică
Chimie / / July 04, 2021
Energia chimică este cea care provine din reacțiile chimice. Interacțiunea dintre speciile chimice generează ruperea și / sau generarea de legături, ceea ce implică o eliberare sau absorbție de energie, respectiv. Energia chimică se numește energia eliberată, care poate fi utilizată ca energie termică și energie electrică, de exemplu.
Energia în reacțiile chimice
Energia chimică poate fi obținută în expresia maximă din două surse principale: Soluții de combustie și electrolitice. Pe de altă parte, la nivelul corpului uman, este posibil să se obțină energie prin dezintegrarea chimică a alimentelor.
Energie de ardere
De exemplu, când combustibilul metan CH4, cea mai simplă hidrocarbură, începe să ardă în prezența oxidantului de oxigen, se va dezintegra, formând produse de dioxid de carbon CO.2 și Apa H2SAU. În plus, ruperea legăturilor atomilor de hidrogen cu atomii de carbon va elibera energie sub formă de căldură.
CH4 (g) + 2O2 (g) → CO2 (g) + 2H2 O (l) ∆H = -212,8 Kcal / mol
Ecuația de ardere a metanului. Căldura acestei reacții este reprezentată de ΔH. Semnul negativ indică eliberarea Energiei. Reacția este exotermă.
 Arderea gazului metan. Reacția se manifestă cu o flacără.
Arderea gazului metan. Reacția se manifestă cu o flacără.
Exemple de încălziri de ardere a compușilor organici la 25 ° C.
Compus |
Formulă |
ΔH (Kcal / mol) |
Metan (g) |
CH4 |
-212.80 |
Etan (g) |
C2H6 |
-372.82 |
Propan (g) |
C3H8 |
-530.60 |
n-butan (g) |
C4H10 |
-687.98 |
n-pentan (g) |
C5H12 |
-845.16 |
Etilenă (g) |
C2H4 |
-337.23 |
Acetilenă (g) |
C2H2 |
-310.62 |
Benzen (g) |
C6H6 |
-787.20 |
Benzen (l) |
C6H6 |
-780.98 |
Toluen (l) |
C7H8 |
-934.50 |
Naftalină (s) |
C10H8 |
-1,228.18 |
Zaharoză |
C12H22SAU11 |
-1,348.90 |
Metanol (l) |
CH3Oh |
-173.67 |
Etanol (l) |
C2H5Oh |
-326.70 |
Acid acetic (l) |
CH3COOH |
-208.34 |
Acizi benzoici |
C6H5COOH |
-771.20 |
Pentru ca un combustibil să furnizeze toată căldura de ardere de care este capabil, acesta trebuie să fie într-o stare gazoasă. După cum se poate vedea în tabel, benzenul lichid contribuie la o căldură de ardere cu 6,22 Kcal / mol mai mică decât cea eliberată de benzenul gazos. Aceasta înseamnă că trebuie investit 6,22 Kcal / mol pentru a face trecerea de la lichid la gaz.
Faceți clic pentru mai multe informații despre Combustibili.
Soluții electrolitice Energie
Un conductor electrolitic este un mediu în care este implicată una sau mai multe specii ionice, care este dispersat cu încărcătura sa electrică, permițând trecerea unui curent electric Constituţie. Soluțiile electrolitice sunt conductori electrolitici.
Conductorii electrolitici includ, pe lângă soluțiile de electroliți, Săruri topite și, de asemenea, unele săruri solide, cum ar fi clorură de sodiu NaCl și nitrat de argint AgNO3.
Transferul de electroni are loc prin migrație ionică, pozitivă și negativă, către electrozi. Această migrație implică nu numai un transfer de energie electrică, ci și transportul materiei dintr-o parte a conductorului în alta.
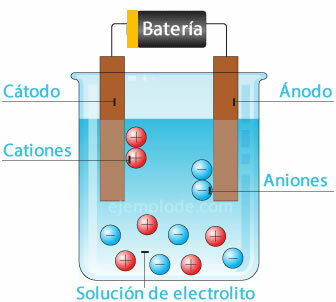 Celula electrochimică
Celula electrochimică
Conectarea unei surse potențiale la electrozii metalici (catod și anod) și scufundarea acestora într-un Soluție apoasă, electronii vor călători prin anod, pentru a scăpa de soluție la polul pozitiv al Fântână. Acesta este cazul, de exemplu, cu un ion clorură, care este eliberat din electronul său și deja cu o sarcină neutră, se alătură unui alt atom de clor, pentru a forma molecula diatomică. Clorul gazos va scăpa de soluție.
2Cl- = 2Cl + 2e-
Electronii care părăsesc polul negativ al sursei vor fi adăpostiți în catodul scufundat. Speciile prezente în soluția apoasă (ioni) vor lua electronii din catod. De exemplu, ionii de hidrogen care alcătuiesc apa, având o sarcină pozitivă, au luat un electron care trebuie neutralizat și unit cu un alt atom de hidrogen pentru a forma molecula diatomic. Va scăpa ca hidrogen gazos din soluție.
2H+ + 2e- = 2H
2H = H2 (g)
Acest schimb de electroni poate sprijini funcționarea bateriilor auto, care constau din electrozi de plumb Pb cufundați într-o soluție de acid sulfuric H2SW4.
Aceeași energie se obține în toate tipurile de baterii care sunt manipulate la nivel intern: 9V, AA, AAA, D, pentru a numi câteva exemple.
Energia alimentară
Ființele umane asimilează energia care este eliberată prin dezintegrarea alimentelor pe care le consumăm în corpul nostru. Această energie este ceea ce corpul nostru folosește pentru funcții neconștiente (digestie, bătăi ale inimii, funcții celulare) și cele pe care le desfășurăm.
Atâta timp cât nu aveți activitate fizică intensă și metabolismul dvs. este lent, este recomandabil să aveți un aport caloric regulat, deoarece alimentele bogate în Lipidele și carbohidrații complecși, care au structuri foarte mari, sunt mai greu de descompus, rezultând o inversare a Energie. În acest caz, efectul ar fi momentan opus.
Este recomandabil să consumați fructe atunci când trebuie să lucrați noaptea, deoarece fructul conține fructoză, un carbohidrat simplu care este ușor de descompus și care va avea la dispoziție energie după noi consum.
Energia chimică și transformările sale
Centrale termoelectrice
Combustibilii grei sunt utilizați în centralele termoelectrice pentru a avea o putere calorică ridicată și de lungă durată. În general, este combustibil (combustibil). Arderea, care este etapa chimică a procesului, va servi ca agent de încălzire pentru un cazan, care va genera abur saturat. Acest abur va ieși sub presiune prin rețeaua de distribuție a aburului și va începe să miște turbinele generatorului. Aceste dispozitive vor produce energie electrică pentru a furniza populația corespunzătoare.
Energie chimică → Energie mecanică → Energie electrică
Operarea automobilelor
Mașinile depind de o sursă de energie, care este bateria. În baterie, se știe deja că are loc conducerea electrolitică, care alimentează sistemul de aprindere, accesoriile bordului și prizele de alimentare auxiliare. Datorită acestei energie electrică disponibilă, mașina se va putea deplasa pentru a duce șoferul în locul dorit.
Energie chimică → Energie electrică → Energie mecanică



