Exemplu de Legea lui Charles
Fizică / / July 04, 2021
Legea gazului lui Charles sau Legea presiunii constante este o altă lege a gazelor, enunțată de Gay-Lussac, care a lansat opera lui Jacques Charles, publicată în jur de 20 cu ani înainte.
Legea lui Charles prezice comportamentul unei mase de gaz atunci când presiunea rămâne constantă și temperatura și volumul variază.
Legea lui Charles este enunțată după cum urmează:
La presiune constantă, volumul unui gaz este direct proporțional cu modificarea temperaturii sale.
Presiune constantă: se referă la faptul că presiunea pe care gazul o exercită asupra pereților containerului nu va varia de-a lungul experienței.
Volum: este spațiul ocupat pe care îl ocupă gazul, în general este considerat un container cu pereți care nu se deformează și al cărui capac funcționează ca un piston.
Temperatura: Este creșterea sau pierderea de căldură pe care o suferă gazul în timpul experimentării. Dacă temperatura crește, volumul crește. Dacă temperatura scade, volumul scade și el.
Algebric, Legea lui Charles este exprimată cu următoarea formulă:

Unde:
V = volumul gazului
T = temperatura gazului
k = constanta de proportionalitate pentru acea masa de gaz.
Aceasta înseamnă că pentru o anumită masă de gaz, la presiune constantă, relația dintre volum și variațiile de temperatură, vor avea întotdeauna aceeași relație de proporționalitate, reprezentată de constantă k:

Deci, odată ce constanta este determinată, putem calcula oricare dintre celelalte valori din celelalte date cunoscute:
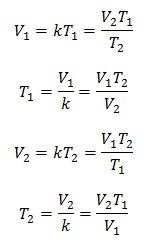
3 Exemple de lege a lui Charles aplicate problemelor:
Exemplul 1: Calculați noul volum, dacă într-un recipient există o masă de gaz care ocupă un volum de 1,3 litri, la o temperatură de 280 K. Calculați volumul la atingerea unei temperaturi de 303 K.
V1 = 1,3 l.
T1 = 280 K
V2 = ?
T2 = 303 K
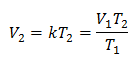
Înlocuirea valorilor:
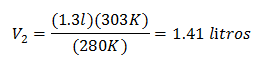
Noul volum la 303 K este de 1,41 litri.
Exemplul 2. Dacă avem un gaz care ocupă 2,4 litri la 10 grade Celsius, calculați temperatura finală, dacă la final ocupă 2,15 litri.
V1 = 2,4 l
T1 = 10 ° C = 283 K
V2 = 2,15 l
T2 = ?
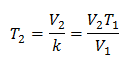
Înlocuirea valorilor:
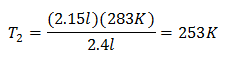
Noua temperatură este de 253 K, care este egală cu -20 ° C.
Exemplul 3. Avem un gaz a cărui temperatură inițială este de 328 K, volumul său final este de 3,75 l, iar raportul său constant este de 0,00885.
V1 = ?
T1 = 328 K
V2 = 3,75 l
T2 = ?
k = 0,00885
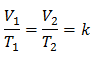
Înlocuirea valorilor:
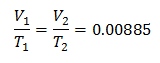
Pentru a cunoaște volumul inițial:
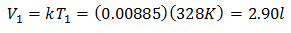
Volumul inițial este de 2,90 l.
Pentru a cunoaște temperatura finală:
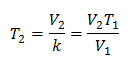
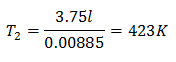
Temperatura finală va fi de 423 K, care este egală cu 150 ° C.


