20 примеров кислотных солей
Разное / / July 04, 2021
в неорганическая химия солями называют соединения, которые получаются при кислота его атомы водорода заменены металлическими катионами (хотя иногда и неметаллическими катионами, например, катион аммония, NH4+). В конкретном случае кислотные соли, атомы водорода кислоты частично замещены, то есть, по меньшей мере, один незамещенный водород остается в составе соли. Этим они отличаются от нейтральные соли, где атомы водорода полностью замещены.
В Вы выходите обычно образуются в результате реакции между кислота и гидроксид (база). В этих реакциях обычно основание теряет свои гидроксильные группы (-ОН), а кислота теряет их. атомы водород (H), образующий нейтральную соль; но если рассматриваемая кислота сохраняет хотя бы один из своих атомов водорода, изменяя электрический заряд реакции, мы получим кислотную соль или гидрогенизированную соль.
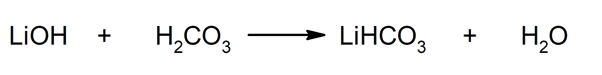
Так, например, бикарбонат лития и вода получают в результате реакции между гидроксидом лития и угольной кислотой:
Номенклатура кислотных солей
Кислотные соли можно назвать по три типа наиболее распространенная номенклатура:
Примеры кислотных солей
- Бикарбонат натрия (NaHCO3). Также называемый гидрокарбонатом натрия (IV), это белое кристаллическое твердое вещество, растворимое в воде, которое можно найти в природе в состоянии минеральная или это может быть произведено в лаборатории. Это одна из самых известных кислотных солей, которая широко используется в кондитерских изделиях, фармакологии и производстве йогуртов.
- Бикарбонат лития (LiHCO3). Эта кислотная соль использовалась в качестве улавливающего агента для CO.2 в ситуациях, когда такой газ нежелателен, как в североамериканских космических миссиях «Аполлон».
- Дигидрофосфат калия (KH2PO4). Это твердое кристаллическое вещество без запаха, растворимое в воде, широко используемое в различных отраслях промышленности, таких как дрожжи еда, хелатирующий агент, питательный обогатитель и помощник в процессах ферментации.
- Бисульфат натрия (NaHSO4). Это кислотная соль, образованная при нейтрализации серной кислоты. Он широко используется в промышленности при рафинировании металлов и чистящих средств. Хотя он очень токсичен для некоторых иглокожих, он используется в качестве добавки в корма для домашних животных и в производстве ювелирных изделий.
- Сероводород натрия (NaHS). Это опасное соединение, поскольку оно очень едкое и токсичное. Он может вызвать серьезные ожоги кожи и повреждение глаз, так как он также горючий.
- Гидрофосфат кальция (CaHPO4). Он используется как пищевая добавка в хлопья для крупного рогатого скота. Это твердое вещество, нерастворимое в воде, но способное кристаллизоваться при гидратации при употреблении двух молекулы воды.
- Гидрокарбонат аммония ([NH4] HCO3). Также известный как «бикарбонат аммония», он используется в пищевой промышленности как дрожжи. химический, хотя он имеет недостаток, заключающийся в улавливании аммиака и придании еде неприятного вкуса избыток. Он также используется в огнетушителях, производстве пигментов и вспенивании резины.
- Бикарбонат бариили (Ba [HCO3]2). Это кислотная соль, которая при нагревании может обратить вспять реакцию производства и очень нестабильна, за исключением растворения. Он широко используется в керамической промышленности.
- Бисульфит натрия (NaHSO3). Эта соль крайне нестабильна и в присутствии кислорода превращается в сульфат натрия (Na2ЮЗ4), поэтому он используется в пищевой промышленности в качестве консерванта и осушителя. Это экстремальный восстанавливающий агент, который широко используется людьми, а также используется для закрепления цветов.
- Цитрат кальция (AC3[C6ЧАС5ИЛИ ЖЕ7]2). Обычно известная как горькая соль, она используется в качестве пищевого консерванта и в качестве пищевой добавки, когда она связана с аминокислотой лизином. Это белый кристаллический порошок без запаха.
- Монокальций фосфат (Ca [H2PO4]2). Это бесцветное твердое вещество, получаемое в результате реакции гидроксида кальция и фосфорной кислоты, широко используемое в качестве разрыхлителя или удобрения в сельскохозяйственных работах.
- Дикальция фосфат (CaHPO4). Также известный как моногидрофосфат кальция, он имеет три различные кристаллические формы, которые используются в качестве добавки к пище и присутствует в зубных пастах. Кроме того, он естественным образом образуется в камнях в почках и в так называемом «почечном камне».
- Мономагний фосфат (MgH4п2ИЛИ ЖЕ8). Это белая кристаллическая соль без запаха, частично растворимая в воде. Он используется для консервирования пищевых продуктов, как подкислитель, как корректор кислотности или средство при лечении мука.
- Диацетат натрия (NaH [C2ЧАС3ИЛИ ЖЕ2]2). Эта соль используется в качестве ароматизатора и консерванта в еде, что предотвращает или задерживает появление грибы и микобактерии, как в продуктах вакуумной упаковки, таких как мясные продукты, так и в мучной промышленности.
- Бикарбонат кальция (Ca [HCO3]2). Это гидрогенизированная соль, происходящая из карбоната кальция, присутствующего в таких минералах, как известняк, мрамор и другие. В этой реакции присутствуют вода и CO.2, поэтому это может произойти спонтанно в пещерах и пещерах, богатых кальцием.
- Фторид рубидиевой кислоты (RbHF). Эта соль получается в результате реакции фтористоводородной кислоты (водорода и фтора) и рубидия, щелочного металла. В результате получается токсичное и едкое соединение, с которым нужно обращаться осторожно.
- Моноаммоний фосфат ([NH4] H2PO4). Это водорастворимая соль, получаемая при реакции аммиака и фосфорной кислоты. Обычно его используют в качестве удобрения, так как он придает почве питательные вещества азота и фосфора, необходимых для роста растений. Он также входит в состав порошка ABC в огнетушителях.
- Ортоборат цинка водорода (Zn [HBO3]). Это соль, используемая как антисептик и добавка при производстве керамики.
- Мононатрий фосфат (Неа2PO4). Он используется в основном в лабораториях в качестве «буфера» или буферного раствора, который предотвращает резкие изменения pH раствора.
- Гидрофталат калия (KHP). Также называемый «фталат калия кислоты», это твердая и стабильная соль в обычном воздухе, поэтому ее часто используют в качестве основного стандарта при измерении pH. Он также полезен как буферный агент в химические реакции.
Следуйте с: