20 примеров ковалентных связей
Разное / / July 04, 2021
Много химические соединения состоят из молекулы которые, в свою очередь, состоят из атомы. Чтобы образовать молекулы, атомы соединяются, образуя химические связи.
Не все химические связи одинаковы: они в основном зависят от электронных характеристик задействованных атомов, их значений электроотрицательности, среди других факторов. Наиболее распространенные типы ссылок: ионные связи и ковалентные связи.
Ковалентные связи образуются между неметаллическими атомами одного и того же химический элемент, между неметаллическими атомами различных элементов с разницей электроотрицательностей, не превышающей 1,7, и между неметалл и водород. Например: дихлор, молекулярный кислород, вода.
Ковалентная связь образуется, когда два из этих атомов разделяют электроны своего последнего энергетического уровня для выполнения Правило октета, который устанавливает, что ионы различных химических элементов, содержащихся в Периодическая таблица имеют тенденцию завершать свои последние энергетические уровни с помощью 8 электронов, так что молекулы могут приобретать стабильность, аналогичную стабильности
благородные газы.Следовательно, способ, которым эти вещества или химические соединения достигают стабильности, заключается в разделении пары электронов (по одному от каждого атома). Таким образом, общая пара электронов является общей для двух атомов и в то же время удерживает их вместе.
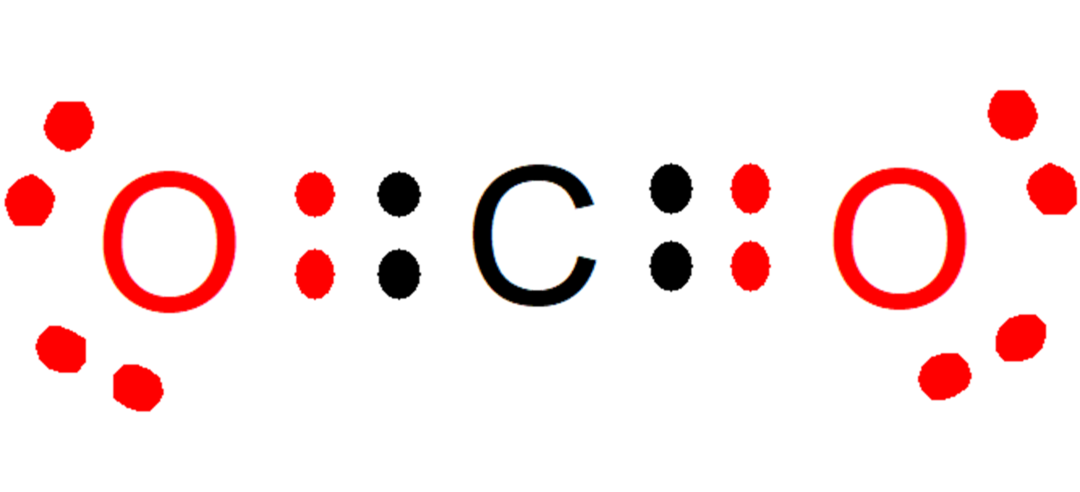
Например, в диоксид углерода (CO2), каждый кислород вносит два электрона (красный цвет) в связь с углеродом, в то время как углерод вносит два электрона (черный цвет) в каждую связь с каждым кислородом. В образовавшемся соединении на каждом атоме остается 8 электронов, и, таким образом, Правило октета выполняется.
Типы ссылок
Есть принципиально три типа ковалентных связей, хотя важно уточнить, что никакая связь не является абсолютно ковалентной или абсолютно ионной. Все связи имеют определенный процент ковалентной и ионной связи, фактически, ионная связь иногда рассматривается как «преувеличение» ковалентной связи. В этом смысле могут возникать следующие типы ковалентной связи:
Вещества, состоящие из ковалентных молекул
В вещества которые содержат ковалентные молекулы может произойти в любом состоянии материи (твердое, жидкое или газообразное) и, в общем, являются плохими проводниками горячий и из электричество.
Есть молекулярные ковалентные вещества и ретикулярные ковалентные вещества. В молекулярные коваленты они имеют низкие температуры кипения и плавления, растворимы в неполярных растворителях (таких как бензол или четыреххлористый углерод) и мягкие в твердом состоянии. В решеточные коваленты Они образуют кристаллические решетки, поэтому имеют более высокие температуры плавления и кипения и представляют собой твердые нерастворимые твердые вещества.
Примеры ковалентных связей
Можно привести многочисленные примеры соединений или веществ, содержащих ковалентные связи:
- Дифтор
- Дибром
- Дихлор
- Diyodo
- Молекулярный кислород
- Воды
- Аммиак
- Углекислый газ
- Метан
- Пропан
- Глюкоза
- Молекулярный азот
- Кварцевый
- Парафин
- Дизель

Следуйте с:

