20 примеров кислот
Разное / / July 04, 2021
В кислоты составляют важную группу химические соединения, очень широкий. Кислоты обычно определяются как соединения, которые могут отдавать один или несколько катионы водород (H+) к другому соединению, известному как база. Хотя на самом деле кислоты определяют по нескольким теориям:
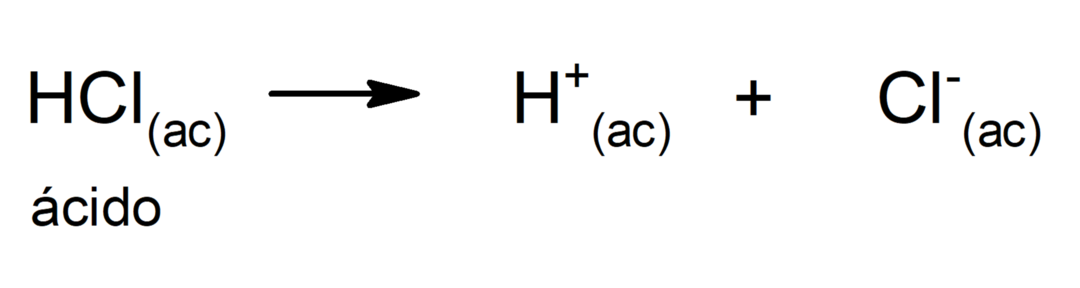 Ограничение этой теории состоит в том, что кислоты определяются только в водном растворе.
Ограничение этой теории состоит в том, что кислоты определяются только в водном растворе. 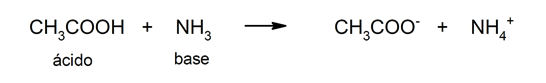

Свойство выпуска катионы водорода это то, что заставляет кислоты производить растворы pH менее 7. Кислоты, которые могут выделять более одного протона (используя это название для H+) называются полипротическими или полифункциональными.
Кислотные свойства
Что касается их характеристики, кислоты можно представить в виде жидкости или как газы, реже как твердый. Кислый вкус, который мы можем распознать и который характеризует эти соединения, мы находим, например, в цитрусовые, богатые лимонной кислотой, или уксус, который представляет собой кислотный раствор уксусная. Это органические кислоты.
существовать органические и неорганические кислоты
; самые сильные - обычно неорганические. Многие органические кислоты играют важную биологическую роль. Среди неорганических есть соляная кислота, которая играет очень важную роль в процессе пищеварения. В нуклеиновые кислоты Они также имеют фундаментальное значение для жизни, поскольку являются основой генетического материала клетки и содержат ключ к синтезу белок.Склонность терять протоны - вот что определяет силу кислоты.
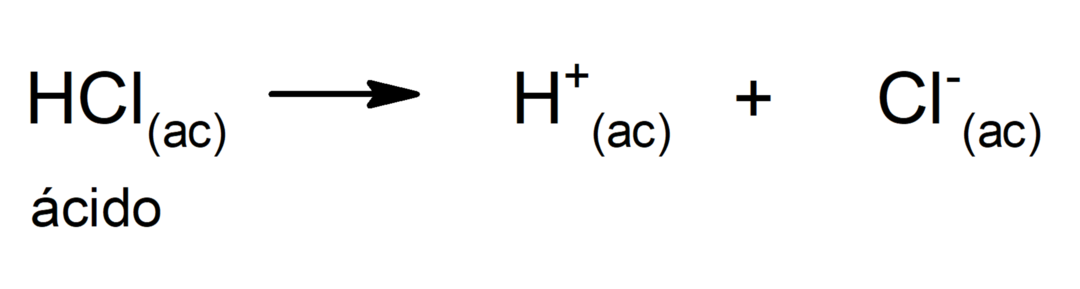
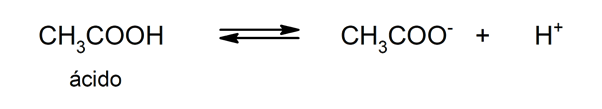
Использование кислот
Кислоты имеют много применений, как в промышленном, так и в бытовом масштабе. Их часто используют в качестве добавок и консервантов в еда, косметика, напитки и др. Некоторые кислые твердые вещества используются в качестве катализаторы (ускорители химических реакций) в нефтехимической или бумажной промышленности.
Есть также кислоты, которые используются в качестве дезинфицирующие средства (карболовая кислота, салициловая кислота). Кроме того, их можно использовать в качестве электролитов в автомобильных аккумуляторах, как в случае с серной кислотой. Последняя сильная кислота также часто используется при переработке минералы, например, в случае производства удобрений из каменных фосфатов.
Следует уточнить, что некоторые вещества могут растворяться только в кислой среде, и что определенные реакции происходят только в таких условиях. Азотная кислота и аммиак образуют нитрат аммония, также важное удобрение для сельскохозяйственных культур.
Примеры кислот
Двадцать кислот перечислены ниже в качестве примера:
- Хлорная кислота (HClO4). Это сильнокислая жидкость. температура среда, сильно окисляющая.
- Азотная кислота (HNO3). Это сильная и сильно окисляющая кислота, используемая для изготовления некоторых взрывчатых веществ, а также азотных удобрений.
- Аскорбиновая кислота (C6ЧАС8ИЛИ ЖЕ6). Это витамин С, так необходимый для здоровья. Это защитное вещество, обладающее антиоксидантным действием.
- Соляная кислота (HCl(ac)). Это единственная сильная кислота, которую синтезирует человеческий организм, процесс, который специально происходит в желудке для разложения еда в пищеварительном процессе.
- Винная кислота (C4ЧАС6ИЛИ ЖЕ6). Это белый кристаллический порошок, его используют при приготовлении шипучих напитков, в хлебопекарной, винной и фармацевтической промышленности. Крем от зубного камня, который есть в некоторых рецептах, - это винная кислота.
- Плавиковая кислота (HF(ac)). Из-за своей способности разрушать стекло, он используется в резьбе по хрусталю и гравировке.
- Серная кислота (H2ЮЗ4). Это по преимуществу сильная кислота, у нее есть бесчисленное множество применений в различных отрасли промышленности и процессы синтеза.
- Трифторуксусная кислота (C2ВЧ3ИЛИ ЖЕ2). Это хороший растворитель для многих органические соединения.
- Фосфорная кислота (H3PO4). Он присутствует (в низких концентрациях) в различных напитках с колой. Он считается вредным для здоровья, поскольку способствует удалению накипи.
- Уксусная кислота (CH3COOH). Это основной компонент уксуса. Кислотность, которую он создает, делает его широко используемым пищевым консервантом.
- Фторантимоновая кислота (SbHF6). Это самая сильная из известных суперкислот, кислотность которой превышает кислотность чистой серной кислоты на 10.19.
- Хромовая кислота (H2CrO4). Это темно-красный порошок, участвует в процессе хромирования. Его также используют для глазурования керамики.
- Индолеуксусная кислота (C10ЧАС9НЕТ2). Это главный представитель ауксинов, важных в гормонах роста растения.
- Дезоксирибонуклеиновая кислота (ДНК). В нем ключ к жизни, поскольку он составляет гены, управляющие синтезом бесчисленных белков.
- Трикарбоновые кислоты. Они включают группу карбоновых кислот, которые имеют три карбоксильные группы (-COOH). Лимонная кислота (C6ЧАС8ИЛИ ЖЕ7) Это один из них.
- Муравьиная кислота (CH2ИЛИ ЖЕ2). Это простейшая из органических кислот. Продолжительное воздействие этой кислоты может вызвать дыхательную недостаточность и смерть.
- Глюконовая кислота (C6ЧАС12ИЛИ ЖЕ7). Соли этой кислоты широко используются в процессах мытья посуды.
- Молочная кислота (C3ЧАС6ИЛИ ЖЕ3). Это важная часть биохимических процессов.
- Бензойная кислота (C7ЧАС6ИЛИ ЖЕ2). Это кислота с характерным запахом, которая широко используется для консервирования продуктов, требующих pH кислота.
- Яблочная кислота (C4ЧАС6ИЛИ ЖЕ5). Он широко используется в фармацевтической промышленности для производства слабительных средств.
- Угольная кислота (H2CO3). В некоторых местах это часть процесса образования пещер. Он присутствует в газированных напитках.


