20 примеров алканов
Разное / / July 04, 2021
В алканы они своего рода углеводороды в котором переменное количество атомов углерода соединено одинарными связями, как скелет, и каждый атом углерода связан, в свою очередь, с атомами водорода, которые в конечном итоге могут быть заменены другими атомы или функциональные группы. Например: хлороформ, метан, октан.
В молекулярная формула алканов с открытой линейной цепью составляет CnH2n + 2, где C представляет собой углерод, H представляет собой водород и n представляет собой количество атомов углерода. Алканы - это насыщенные углеводороды, что означает, что они не имеют двойных или тройных связей. Чтобы назвать их, вы используете суффикс "-Ano" после наименования углеродной цепи с использованием приставка соответствующие количеству атомов углерода (эт- (2), про- (3), но- (4), пен- (5), гекс- (6), геп- (7) и т. д.).
Он может служить вам:
Классификация алканов
В составе алканов их обычно распознают. две большие группы: открытая цепь (также называемая ациклической) и замкнутая цепь (или циклическая).
Когда соединения с открытой цепью В них нет замещения атомов водорода, которые сопровождают каждый атом углерода, они называются линейными алканами: это простейшие алканы. Когда они представляют собой замещение любого из своих атомов водорода одной или несколькими углеродными цепями, их называют разветвленными алканами. Наиболее распространенными заместителями являются этильные группы (CH3CH2-) и метил (CH3-).
С другой стороны, есть соединения с одним циклом в молекуле (моноциклические) и другие с несколькими (полициклическими). В циклические алканы они могут быть гомоциклическими (они образуются исключительно при участии атомов углерода) или гетероциклическими (в которых участвуют другие атомы, например, кислород или сера).
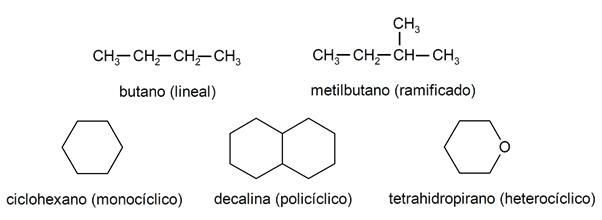
Физические свойства алканов
В общем, физические свойства алканов обусловлены молекулярной массой (в свою очередь, связанной с длиной углеродной цепи). Те, у кого наименьшее количество атомов углерода, газообразный к температура окружающей среде, от 5 до 18 атомов углерода являются жидкости, а выше этого числа твердый (похож на воск).
Будучи менее плотными, чем вода, они имеют тенденцию плавать на ней. Как правило, алканы нерастворимы в воде и растворимы в органических растворителях.
Смысл кипячение и из слияние алканов зависит от их молекулярная масса, то есть от длины углеродной цепи, хотя они также во много раз зависят от пространственного расположения атомов. Линейные и циклические алканы имеют более высокие температуры кипения, чем разветвленные.
Химические свойства алканов
Алканы характеризуются тем, что химические соединения очень плохая реактивность, поэтому они также известны как «парафины» (на латыни parum affinis означает «низкое сродство»). Это соединения с очень высокой энергией активации, когда они участвуют в химические реакции. Самая важная реакция, которой могут подвергаться алканы, - это горение генерируя в присутствии кислорода тепло, углекислый газ и воду.
Алканы являются основой для множества разнообразных реакций, связанных с промышленные процессы очень важно, поскольку это самые традиционные виды топлива. Они также появляются как конечные продукты биологических процессов, таких как метаногенная ферментация, осуществляемая некоторыми микроорганизмы.
Примеры алканов
Некоторые примеры алканов (в том числе некоторые хорошо известные линейные и разветвленные):
- Хлороформ (причудливое название трихлорметан; CHCl3). Пары этого вещества использовались как анестетики. Для этой цели он был снят с производства, поскольку было обнаружено, что он повреждает органы важно, например, печень или почки. Сегодня он используется в основном в качестве растворителя или охлаждающей жидкости.
- Метан (CH4). Это простейший алкан: он состоит всего из одного атома углерода и четырех атомов водорода. Это газ, который возникает естественным образом при разложении различных органических субстратов и является основным компонентом природного газа. В последнее время он был признан одним из газов, который больше всего способствует так называемому парниковому эффекту.
- Октан (C8ЧАС18). Это восьмиуглеродный алкан, который имеет большое значение, поскольку определяет конечное качество нафты, которая является смешивание различных углеводородов. Это качество измеряется октановым или октановым числом топлива, которое принимает в качестве эталона низкодетонирующее (индекс 100) и сильно детонирующее (индекс 0).
- Гексан (C6ЧАС14). Это важный растворитель, его следует избегать вдыхания, поскольку он очень токсичен.
- Бутан (C4ЧАС10). Наряду с пропаном (C3ЧАС8), составляют так называемые сжиженные углеводородные газы (LPG), которые образуются в газовых мешках в процессе добычи нефти. В настоящее время продвигается замена бензина или дизельного топлива на сжиженный нефтяной газ в качестве топлива, поскольку это более экологически чистого углеводорода (при сгорании выделяет только углекислый газ и воду).
- Икозано (C20ЧАС42). Это 20-углеродный алкан (приставка ico означает двадцать).
- Циклопропан (C3ЧАС6). Раньше его использовали как обезболивающее.
- н-гептан (C7ЧАС16). Это тот, который берется за точку отсчета для нулевой точки октановой шкалы бензина, что было бы наименее желательным, поскольку оно горит взрывом. Его получают из смолы определенных растения.
- 3-этил-2,3-диметилпентан (C9ЧАС20)
- 2-метилбутан (C5ЧАС12)
- 3-хлор-4-н-пропилгептан (C10ЧАС21Cl)
- 3,4,6-триметилгептан (C10ЧАС22)
- 1-бром-2-фенилэтан (C8ЧАС9Br)
- 3-этил-4-метилгексан (C9ЧАС18)
- 5-изопропил-3-метилнонан (C13ЧАС28)
- Кубинец (C8ЧАС8)
- 1-бромпропан (C3ЧАС7Br)
- 3-метил-5-н-пропилоктан (C12ЧАС26)
- 5-н-бутил-4,7-диэтилдекан (C18ЧАС28)
- 3,3-диметилдекан (C12ЧАС26)