100 примеров химических элементов
Разное / / November 13, 2021
В химические элементы относятся к типу вопросов, которые ни в коем случае химическая реакция их можно уменьшить или разложить на другие более простые элементы. По этой причине можно сказать, что элемент - это все иметь значение сделано в атомы одного и того же уникального класса, то есть атомы с одинаковым атомным номером (равным числом протонов), хотя и разной атомной массой. Например: сера, бор, хром, олово.
Первое определение химического элемента было введено Лавуазье в Traité Élémentaire de Chimie, в 1789 г. Еще в 18 веке Лавуазье разделил простые вещества на четыре группы:
Периодическая таблица элементов
Сегодня они знают друг друга 118 химических элементов. Все они собраны, классифицированы и организованы в соответствии со многими из их свойств в графической схеме, известной как Периодическая таблица элементов, которая была первоначально создана русским химиком. Дмитрий Менделеев в 1869 г. Периодическая таблица состоит из 18 групп (столбцов) и 7 периодов (строк), в которых расположены химические элементы.
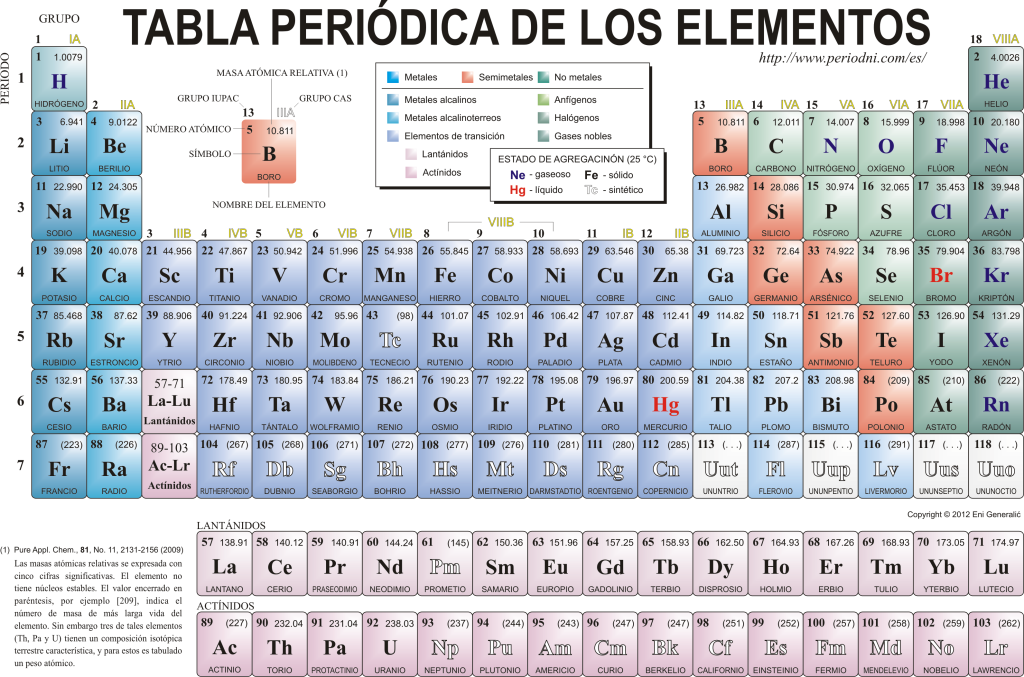
В основные группы в этой таблице можно найти:
Щелочные металлы (Группа 1), щелочноземельные металлы (Группа 2), семейство скандия, которое включает в себя земли и актиниды (Группа 3), семейство титана. (Группа 4), семейство ванадия (Группа 5), семейство хрома (Группа 6), семейство марганца (Группа 7), семейство железа (Группа 8), семейство кобальта (Группа 9), семейство никеля (группа 10), семейство меди (группа 11), семейство цинка (группа 12), земные элементы (группа 13), карбонидные элементы, в этой группе входят углерод, составляющий основу жизни на Земле (группа 14), азотообразующие элементы (группа 15), амфигенетические элементы, включая кислород, фундаментальный элемент для в дыхание принадлежащий живые существа (Группа 16), галогеновые элементы (Группа 17) и благородные газы (Группа 18).
Многие из этих элементов имеют стабильные или радиоактивные изотопы, то есть один и тот же химический элемент, например водород (H), может иметь несколько изотопов (1ЧАС, 2ЧАС, 3ЧАС). Это означает, что каждый атом изотопа имеет одинаковое количество протонов (что означает, что он принадлежит к одному химическому элементу) и разное количество нейтронов.
Некоторые изотопы нестабильны (радиоактивны), то есть распадаться в определенное время испускает определенные частицы (нейтроны, фотоны, альфа-частицы и другие) и генерирует другие стабильные или радиоактивные изотопы. Химические элементы обладают такими свойствами, как точка кипячение и что из слияние, электроотрицательность, плотность и ионный радиус, среди прочего. Эти свойства важны, потому что они позволяют нам предсказать его поведение, реактивность и т. Д.
Как элементы представлены в Периодической таблице?
Каждый химический элемент характеризуется Периодическая таблица с использованием определенной символики. Во-первых, в центре каждого квадрата свой универсальный символ, состоящий из одного или двух буквы (по соглашению, если есть две буквы, первая пишется заглавными буквами, а следующая - строчными).
Вверху и слева отображается мелким шрифтом su атомный номер, который указывает количество протонов, которые имеет этот элемент. Под символом элемента отображается его имя, а вверху слева - его имя. атомная масса родственник. Кроме того, цвет, которым представлен символ элемента, означает его агрегатное состояние (в соответствии с представлением, используемым в каждой Периодической таблице).
Различные элементы присутствуют атомные радиусы переменные и, чем больше число протонов в ядре, тем больше притяжение, которое ядро оказывает на электроны, поэтому атомный радиус имеет тенденцию к уменьшению. Когда атомный радиус мал, электроны на внешнем уровне облака очень притягиваются к ядру, поэтому они не сдаются легко. Обратное происходит с элементами с большими атомными радиусами: они легко отдают свои внешние электроны.
Таким образом, атомный радиус увеличивается сверху вниз, когда мы проходим через группы Периодической таблицы, и уменьшается слева направо, когда мы проходим их периоды.
Примеры химических элементов
| Химический элемент | Символ |
| Актиний | Ac |
| Алюминий | К |
| Америций | ЯВЛЯЮСЬ |
| Сурьма | Sb |
| Аргон | Ar |
| Мышьяк | Туз |
| Astat | В |
| Сера | S |
| Барий | Ба |
| Бериллий | Быть |
| Беркелиум | Bk |
| Висмут | Би |
| Борио | Bh |
| Бор | B |
| Бром | Br |
| Кадмий | CD |
| Кальций | AC |
| Калифорний | Cf |
| Углерод | C |
| Церий | EC |
| Цезий | CS |
| Хлор | Cl |
| Кобальт | Co |
| Медь | Cu |
| Хром | Cr |
| Кюрий | См |
| Дармштадио | Ds |
| Диспрозий | Dy |
| Дубний | Db |
| Эйнштейний | это |
| Эрбий | Э |
| Скандий | Sc |
| Банка | Sn |
| Стронций | Мистер |
| Европий | Евросоюз |
| Фермий | FM |
| Фтор | F |
| Матч | п |
| Франций | Пт |
| Гадолиний | Б-г |
| Галлий | Ga |
| Германий | Ge |
| Гафний | Hf |
| Hassio | Hs |
| Гелий | у меня есть |
| Водород | ЧАС |
| Утюг | Вера |
| Гольмий | Хо |
| Индийский | В |
| Йод | я |
| Иридий | Идти |
| Иттербий | Yb |
| Иттрий | Y |
| Криптон | Kr |
| Лантан | В |
| Лоуренсио | Lr |
| Литий | Ли |
| Лютеций | Пн |
| Магний | Mg |
| Марганец | Mn |
| Мейтнериус | Mt |
| Менделевий | Мкр |
| Меркурий | Hg |
| Молибден | Пн |
| Неодим | Na |
| Неон | Ne |
| Нептуний | Np |
| Ниобий | Nb |
| Никель | Ни один |
| Азот | N |
| Нобелио | Нет |
| Золото | Au |
| Осмий | Ты |
| Кислород | ИЛИ ЖЕ |
| Палладий | P.S |
| Серебро | Ag |
| Платина | Pt |
| Вести | Pb |
| Плутоний | Пу |
| Полоний | По |
| Калий | K |
| Празеодим | Pr |
| Обещать | Вечера |
| Протактиний | Па |
| Радио | Ра |
| Радон | Rn |
| Рений | Re |
| Родий | Rh |
| Рубидий | Руб. |
| Рутений | RU |
| Резерфордио | Rf |
| Самарий | Вы |
| Сиборджио | Sg |
| Селен | я знаю |
| Кремний | да |
| Натрий | Na |
| Таллий | Tl |
| Тантал | Та |
| Технеций | Tc |
| Теллур | Чай |
| Тербий | Tb |
| Титана | Ты |
| Торий | Чт |
| Тулий | Тм |
| Коперник | Cn |
| Ливерморио | Ур. |
| Рентгенио | Rg |
| Ununoctium | Ууо |
| Унунпентиум | Uup |
| Флеровио | Fl |
| Ununseptio | Uus |
| Ununtrium | Уут |
| Уран | ИЛИ ЖЕ |
| Ванадий | V |
| Вольфрам | W |
| Ксенон | Xe |
| Цинк | Zn |
| Цирконий | Zr |

Следуйте с:



