Определение химического равновесия
Запрет Струнная теория / / April 02, 2023
1. Условие стабильности присуще обратимым реакциям, когда скорости прямой и обратной реакции всегда остаются одинаковыми.
Кот. грамматический: существительное мужского рода
по слогам: e-qui-li-brio + qui-mi-co.
Химический баланс

Инженер-химик
Реакция в баланс химическое, когда скорость реакции прямой равен скорость обратная реакция. Все химическая реакция обладает определенной спонтанностью к равновесию, и для ее исследования мы делаем это через знак ∆G, Энергия Гиббса, что означает, что по значению этой величины мы можем предсказать, произойдет ли реакция в определенном направлении или нет.
Изменение свободной энергии Гиббса выражается, вообще говоря, в стандартных условиях как разница между энергиями продуктов и реагентов также в стандартном состоянии:
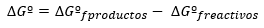
В то время как, если реакция протекает в нестандартных условиях, соотношение между ∆Gº и ∆G определяется следующим выражение:
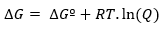
где Q — коэффициент реакции.
Чтобы понять значение скорости реакции и химического равновесия, мы должны изучить знак ∆G:
Если ∆G отрицательно, это означает, что реакция идет самопроизвольно (происходит) в прямом смысле.
Положительное значение ∆G означает, что реакция не является самопроизвольной (не происходит) в прямом смысле.
А если ∆G=0, то изменений не будет, так как система находится в равновесии, а как уже говорилось, скорость прямой реакции равна скорости косвенной реакции. Это означает, что коэффициент реакции Q равен константе равновесия K, поэтому нет тенденции отдавать предпочтение определенному направлению реакции.
Поскольку Q определяется как:
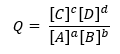
Для общей реакции:
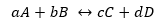
При этом К принимает ту же форму, но с равновесными концентрациями.
Если мы вернемся к случаю, когда ∆G отрицательно, то это означает, что коэффициент реакции Q меньше, чем K (константа равновесие), подразумевает, что концентрации продуктов меньше, чем они должны быть, если бы реакция шла. баланс. Поэтому с точки зрения спонтанности она становится спонтанной в прямом смысле.
Тогда как, если ∆G положителен, будет преобладание продуктов над тем, что должно быть, если бы система находилась в равновесии, при этом Q больше, чем K. Следовательно, реакция идет самопроизвольно в обратном направлении.
Следует отметить, что строгое определение Q и K дается с точки зрения активности продуктов и реагентов, определяя активность с точки зрения концентрации или давления как:
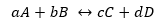
Хорошо:
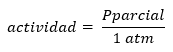
Отсюда следует, что и Q, и K безразмерны и могут рассматриваться как в концентрациях, так и в парциальных давлениях.
Когда концентрации или парциальные давления продуктов и реагентов остаются постоянными во времени, возникает ситуация химическое равновесие, а ситуация динамического равновесия достигается за счет того, что скорость прямой и обратной реакции с идентичный. Важно выделить динамизм равновесия, скорость, с которой они формируются и продукты потребления и реагенты одинаковы, поэтому концентрации или парциальные давления не различается.
Если состояние отклоняется от положения равновесия, одни виды будут преобладать над другими, и отсюда возникает выражение, связывающее скорость прямой и обратной реакции Кс:
Предположим, реакция показана выше:
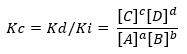
Будучи Kd и Ki, скорость реакции постоянна в прямом или обратном направлении соответственно.
Опять же, если Kc>1, это означает, что Ki меньше Kd, поэтому имеет место высокая степень превращения продуктов в реагенты. В этом случае равновесие смещается в сторону продуктов.
Обратное происходит, если Kc<1, что означает, что скорость прямой реакции ниже, чем скорость косвенной реакции, и мало потребление реагентов равновесие смещается в сторону реагентов.
Если же Kc=1, то скорости равны и система находится в равновесии.
Важно определить два момента: во-первых, значение этой константы зависит исключительно от температура и, в свою очередь, изменяется в зависимости от величины, используемой для выражения концентраций или давлений продуктов и реагентов.
Наконец, закон Химическое равновесие корректируется для разбавленных растворов или газов при низком давлении.
