30 примеров альдегидов
Примеры / / November 06, 2023
альдегиды являются органические соединения которые образованы углеродной цепью, к которой присоединена концевая карбонильная группа (= C = O) (расположенная на одном конце молекула), который, в свою очередь, связан с атомом водорода.
Наиболее распространенными альдегидами являются метаналь (формальдегид), этаналь (ацетальдегид) и пропаналь (пропалдегид).

Некоторые из этих соединений присутствуют в природе, например, ванилин или ванилин — природный альдегид, составляющий основной ароматизатор ванили.
- Смотрите также: Альдегиды и кетоны.
Номенклатура альдегидов
Альдегидам можно давать названия, используя правила номенклатуры, установленные Международным союзом теоретической и прикладной химии (IUPAC).
Для названия альдегида используются префиксы, обозначающие количество атомов углерода, которые углеродная цепь присоединила к карбонильной группе. Карбонильная группа всегда находится на одном конце углеродной цепи, а это значит, что она всегда будет в положении единица и указывать ее расположение в цепи не обязательно. Кроме того, в конце названия альдегида ставится суффикс -al. Некоторые примеры:
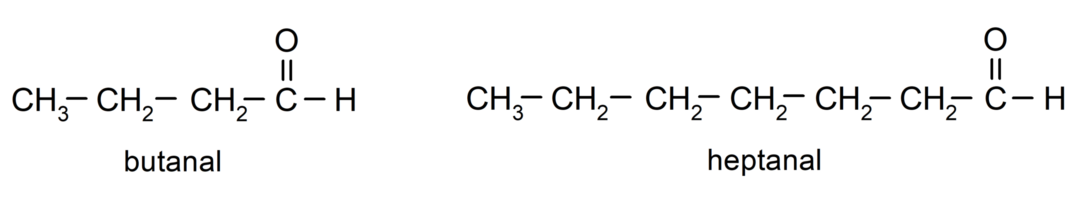
Если альдегид разветвлен, то есть состоит из нескольких углеродных цепей, то основная цепь – это цепь, имеющая наибольшее число атомов углерода и содержащая также группу карбонил. Остальные цепи называются группами заместителей.
Кроме того, каждая группа-заместитель должна быть выбрана так, чтобы ее положение занимало минимально возможный номер в основной углеродной цепи. С другой стороны, атомы углерода основной цепи начинают отсчитывать с того конца, который содержит карбонильную группу. Некоторые примеры:
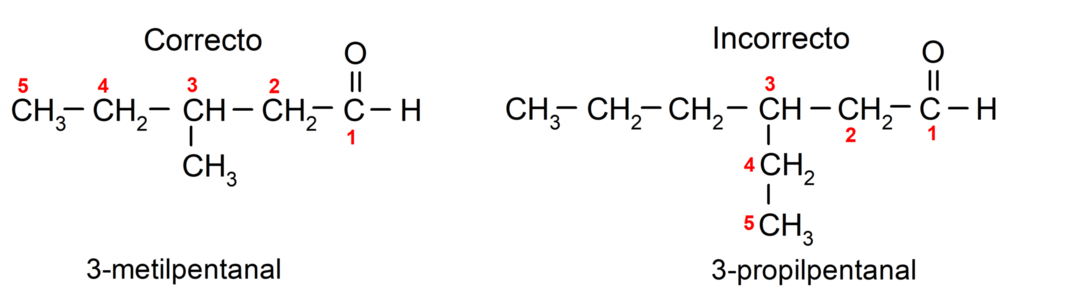
Если альдегид выступает заместителем в молекуле, так как он тоже состоит из групп функциональные группы с более высоким приоритетом, такие как кислоты и сложные эфиры, тогда альдегидная группа называется -оксо. Например:

Если альдегид имеет несколько карбонильных групп, его называют с помощью приставок, обозначающих число этих групп, диал (две карбонильные группы), триал (три карбонильные группы) и т. д. Например:
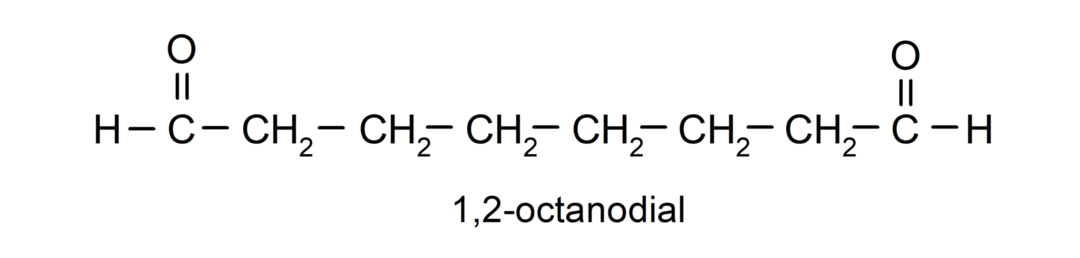
Когда карбонильная группа связана с циклом, альдегиды называют термином карбальдегид. Например:

Физические свойства альдегидов
Альдегиды обычно имеют некоторые вариации одних и тех же физических свойств. Это происходит потому, что физические свойства альдегидов зависят от того, как образуется углеродная цепь, присоединенная к карбонильной группе.
Некоторые физические свойства альдегидов:
- Растворимость. Растворимость альдегидов в воде зависит от количества атомы у которого есть углеродная цепь. Альдегиды с более короткими углеродными цепями (примерно до пяти атомов углерода) растворимы в воде. Альдегиды с углеродными цепями из многих атомов углерода не растворимы в воде. Метаналь и этаналь хорошо растворимы в воде.
- Плотность. В общем, альдегиды — это соединения менее плотные, чем вода.
- Состояния агрегации. Альдегиды, состоящие из одного и двух атомов углерода, называются газы, те, которые содержат от трех до двенадцати атомов углерода, называются жидкости, а те, которые состоят из более чем двенадцати атомов углерода, являются твердыми.
- Запах. Некоторые альдегиды имеют раздражающий запах, а другие — приятный.
- Полярность. Карбонильная группа придает им полярность.
- Точка кипения. Они имеют более высокие температуры кипения, чем алканы с аналогичной молекулярной массой, и более низкие температуры кипения, чем карбоновые кислоты и спирты с сопоставимой молекулярной массой.
Химические свойства альдегидов
Некоторые химические свойства альдегидов:
Альдегиды окисляются при взаимодействии с реагентами Толленса, Бенедикта и Фелинга. с образованием соответствующей карбоновой кислоты. Образующаяся кислота будет иметь такое же количество атомов углерода в углеродной цепи, что и альдегид, из которого она образовалась. Например:
- Окисление реактивом Толленса (аммиачный комплекс серебра в основном растворе, [Ag (NH3)2]+). В результате этой реакции образуется соответствующая кислота и металлическое серебро.

- Окисление реактивом Бенедикта и Фелинга (щелочные растворы сульфата меди (II) (CuSO4) с разными составами). В результате этой реакции образуется соответствующая кислота и оксид меди (Cu2ИЛИ).

Они вступают в реакции нуклеофильного присоединения., где к карбонильной группе альдегидов присоединяются нуклеофилы. Некоторые примеры:
- реакции присоединения спирты к карбонильной группе альдегидов с образованием ацеталей и полуацеталей.
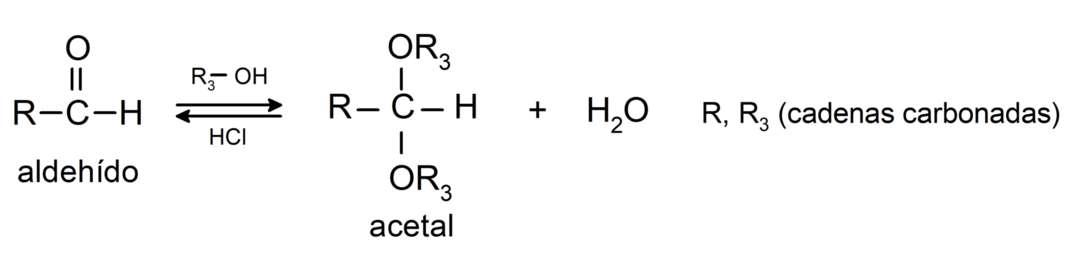
- реакции присоединения амины первичен по отношению к карбонильной группе.

- Реакции присоединения синильной кислоты (HCN), в которых образуются циангидрины или циангидрины.

Вступают в реакции альдольной конденсации.. В реакциях этого типа два альдегида конденсируются с образованием альдола. Это реакции, которые происходят с гидроксидом натрия (NaOH). Например:
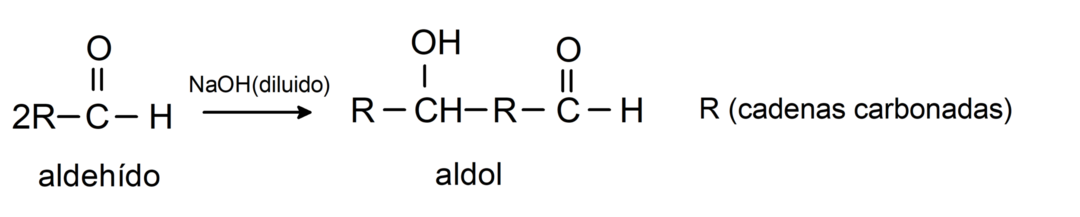
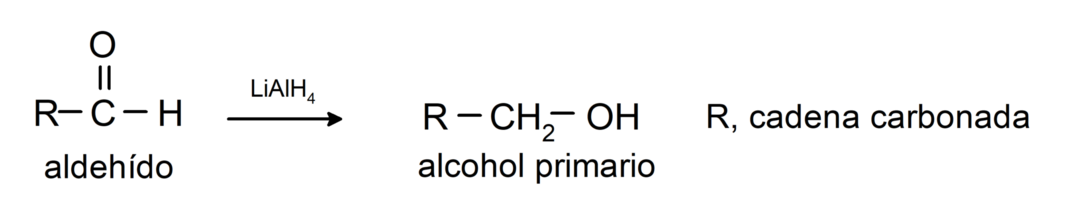
Они подвергаются реакциям восстановления до первичных спиртов.. В присутствии борогидрида натрия (NaBH4) и алюмогидрида лития (LiAlH4) или путем каталитического гидрирования они восстанавливаются до первичных спиртов. Например:
Примеры альдегидов
- метаналь (формальдегид)
- этаналь (ацетальдегид)
- пропаналь (пропалдегид)
- бутаналь
- пентаналь
- ванилин
- коричный альдегид
- пропенальный
- бензальдегид
- гексаналь
- 3-бромциклопентанкарбальдегид
- циклогексанкарбальдегид
- 4,4-диметилпентаналь
- 2-гидроксибутаналь
- 2-гидрокси-2-метилбутаналь
- 2,3-диметилпентаналь
- пятидиапазонный
- циклопентанкарбальдегид
- изобутаналь
- 2-хлорбутаналь

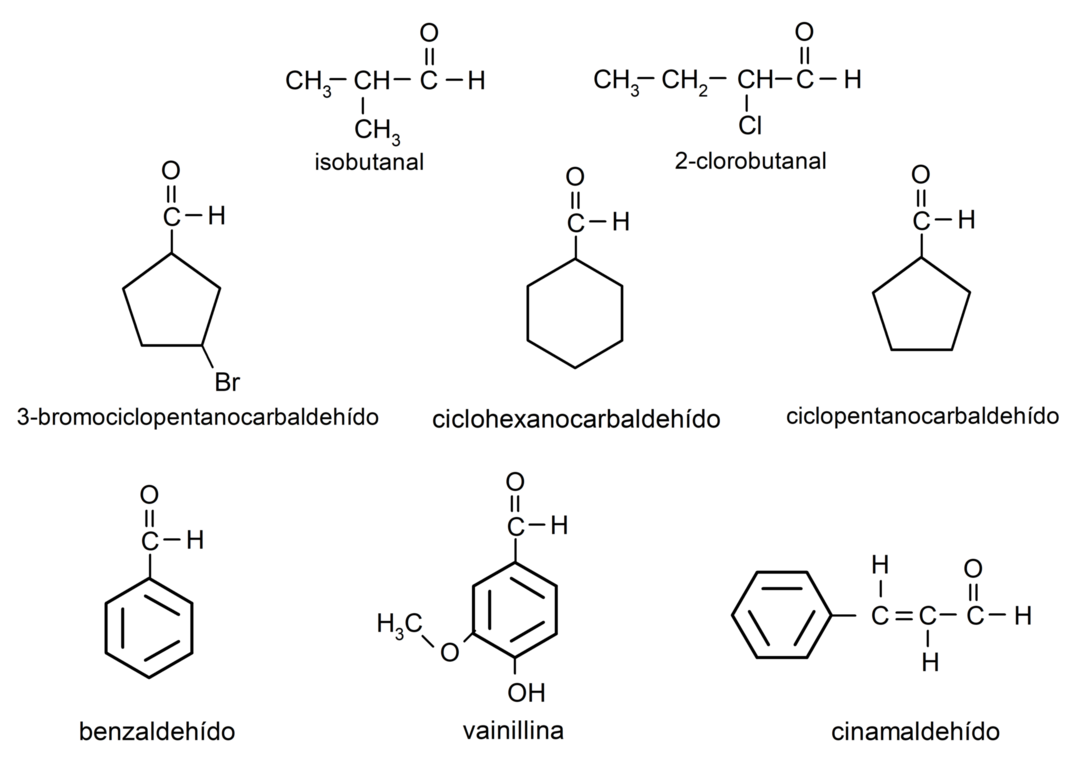
Альдегиды в природе
Некоторые альдегиды, присутствующие в природе:
- Бензальдегид, компонент миндаля.
- Коричный альдегид — компонент, придающий эссенции корицы запах.
- Ванилин – компонент, придающий ванили ее аромат.
С другой стороны, одна из форм глюкозы, открытая форма, имеет альдегидную функциональную группу.
Считается, что ацетальдегид, который образуется как промежуточное соединение при метаболизме алкоголя, вызывает симптомы похмелья при отравлении алкоголем.
Использование альдегидов
Некоторые из основных применений альдегидов:
- Их используют в производстве растворителей, красок, косметических продуктов и эссенций.
- Их используют при производстве смол. Бакелит состоит из формальдегида и представляет собой смолу, которая очень хорошо работает в качестве электрического изолятора.
- Их использовали как успокаивающее средство. Паральдегид использовался как успокаивающее и снотворное средство, но сейчас он вышел из употребления из-за неприятного запаха.
- Их используют в качестве консервантов для биологических образцов и трупов. В этом смысле широко используется формальдегид.
- Их используют в качестве пищевых ароматизаторов. Примером может служить ванилин, который используют для придания десертам ванильного аромата.
- Их используют в качестве дезинфицирующих средств.
Опасности альдегидов
Некоторые альдегиды считаются канцерогенными, например, формальдегид объявлен канцерогенным соединением по данным ВОЗ (Всемирной организации здравоохранения).
Воздействие и контакт со многими альдегидами вызывает раздражение кожи, глаз и дыхательных путей. С другой стороны, он вызывает контактный дерматит и заболевания печени.
Рекомендации
- Соломонс, Т.В. Грэм и Мария Кристина Сангинес Франчини (1985). “органическая химияМексика, Д.Ф.: Лимуса.
- Уиттен, К. В., Гейли, К. Д., Дэвис, Р. Э., де Сандовал, М. Т. К. О., Мурадас Р. М. г. (1992). “Общая химия" (стр. 108-117). МакГроу-Хилл.
- Артеага, П. М. (2017). “Кетоны и альдегидыСовестно-научный вестник подготовительной школы № 3, 4(8).
Следуйте с:
- Сахара
- Гидракислоты
- Этиловый спирт
- Органические и неорганические соединения


