Примеры эндотермических реакций
Примеры / / November 09, 2023
А эндотермическая реакция Это реакция, которая поглощает энергию из среды в виде тепла. В этих реакциях, чтобы реагенты превратились в продукты, им необходимо поглотить тепло, в результате чего продукты обладают большей энергией, чем реагенты, которые их породили. Некоторые примеры эндотермических реакций: фотосинтез и электролиз воды.
- Смотрите также: Химические реакции
Примеры эндотермических реакций в повседневной жизни
Некоторые из основных эндотермических реакций:
Производство озона в атмосфере. Озон образуется в атмосфере, когда молекулярный кислород ( O2) поглощает ультрафиолетовое излучение и разрушается. Тогда атом кислорода (О) может взаимодействовать с другой молекулой кислорода (О2) и образуют озон (O3).

Электролиз воды. Это процесс применения электроэнергия в воду, чтобы разделить ее на два компонента: водород (H) и кислород (O).
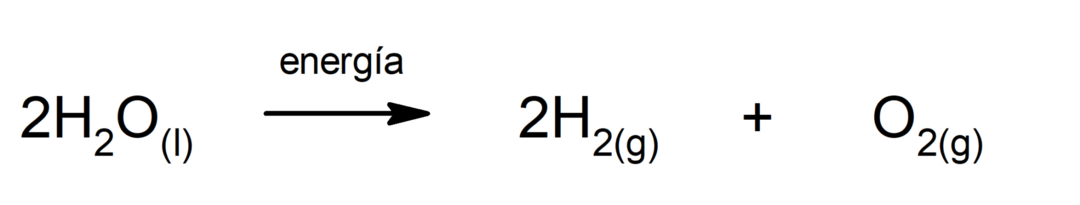
Фотосинтез. Это химическая реакция, при которой поглощение солнечная энергия, диоксид углерода (CO2) превращается в глюкозу. Эта реакция представляет собой основной путь питания растений.
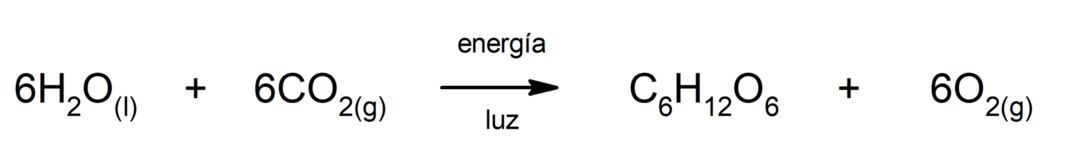
Производство сульфида железа(II). Чтобы произошла реакция между серой и железом, необходимо обеспечить энергию в виде тепла.
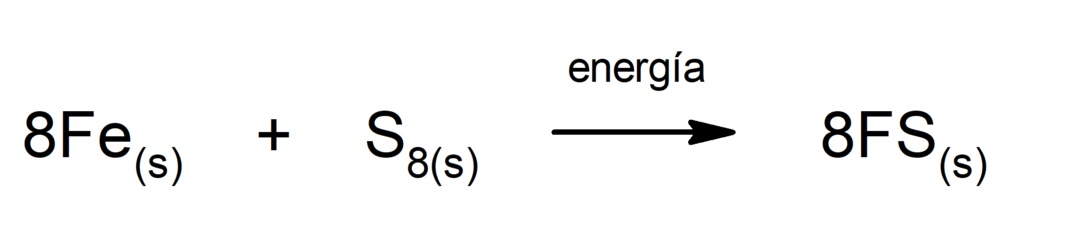
Разложение углекислого газа (CO2). Разложение CO2 При высоких температурах он выделяет окись углерода (CO) и кислород (O).2).
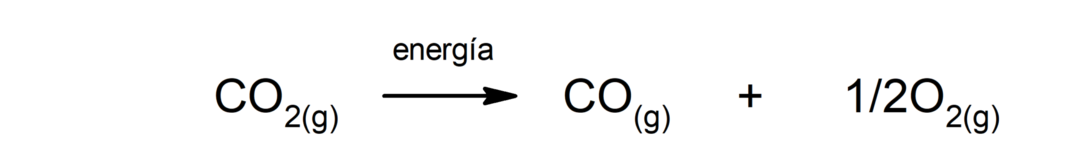
Разложение карбоната кальция (CaCO3). Карбонат кальция разлагается с поглощением тепла с образованием оксида кальция (CaO) и диоксида углерода (CO).2).
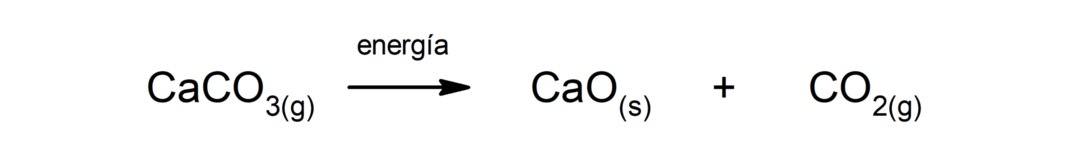
Разница между эндотермической и экзотермической реакцией
Основное различие между эндотермическими и экзотермическими реакциями заключается в том, что эндотермические реакции поглощают тепло, а экзотермические реакции выделяют тепло.
Кроме того, эндотермические реакции характеризуются увеличением энтальпии, тогда как экзотермические реакции связаны с уменьшением энтальпии.
Энтальпия — это термодинамическая величина, определяющая поток тепловой энергии при постоянном давлении во время химической реакции. Он обозначается буквой H, и его изменение является одним из основных показателей, позволяющих определить, является ли химическая реакция эндотермической или экзотермической.
- Если химическая реакция имеет изменение энтальпии больше нуля (ΔH > 0) является эндотермическим.
- Если химическая реакция имеет изменение энтальпии меньше нуля (ΔH < 0) является экзотермическим.
Следуйте с:
- Физико-химические явления
- Химия в повседневной жизни
- Химия в повседневной жизни
- Органическая и неорганическая химия
Рекомендации
- Сото-Кордова, С. (2016). Эндотермические реакции. Технический репозиторий Технологический институт Коста-Рики.
- Короминас, Дж. (2017). Химические реакции повседневной жизни. Алембик, (90), 8–26.
- Санчес, М. Т. М. и Санчес М. М. (2002). Экспериментальное исследование эндотермических реакций у студентов ESO. Анналы химии РГЭВ, (4), 36-39.
