Пример объемного анализа
Химия / / July 04, 2021
На Аналитическая химия, то Объемность это метод анализа, который состоит из Измерение объема реагента, необходимого для стехиометрической реакции с аналитом, которое и является определяемым веществом.
Реагировать стехиометрически относится к веществам, взаимодействующим химически, согласно пропорция, которая отмечает химическое уравнение уже сбалансирован.
Исследуемое вещество называется Аналит. За образец будет взят известный и точно измеренный объем этого вещества, который мы будем называть Аликвота, содержащийся в колбе Эрленмейера, чтобы начать анализ.
Концепции объемного анализа
Объемный анализ, являющийся одним из видов Химический анализ, нести участвовал в химической реакции. Эта химическая реакция будет осуществляться между образцом с неизвестным количеством исследуемого вещества и известным количеством другого вещества, способного реагировать с первым.
В Вещества реакции будут в водном растворе., и будут измеряться объемы растворов, которые взаимодействовали, чтобы достичь конца реакции, что будет видно благодаря индикатору, который будет давать цвет внутри колбы.
При объемном анализе водный раствор Известная концентрация называется стандартным раствором., Стандарт или титрант, и будет служить ориентиром для завершения реакции, чтобы произвести расчет, который покажет количество исследуемого вещества.
Эта процедура приведения в действие обоих решений называется Химическая степень o Оценка, которая является фундаментальной частью объемного анализа. Состоит из постепенно вливая Стандартный раствор (Титрант) в аликвоте (Пример), пока индикатор не покажет изменение с разницей в цвете.
А Показатель Это химическое вещество, которое добавляется к аликвоте, проявляя окраску, и когда реакция закончится, она изменит цвет.
Объемный анализ состоит из простой серии шагов:
1.- Приготовление стандартного раствора
2.- Подготовка образца или аликвоты
3.- Химическая степень
4.- Измерение объема
5.- Расчет исследуемого вещества.
До такой степени, что они уже полностью отреагировал два вещества, это называется Точка эквивалентности.
Как и в любом химическом методе анализа, в объемном анализе есть требования для получения хороших результатов:
-Химическая реакция должна быть Селективный, то есть стандартный раствор будет реагировать только с образцом.
-Химическая реакция должна быть Стехиометрический, то есть соблюдайте пропорции, указанные в сбалансированном химическом уравнении.
-Химическая реакция должна быть Количественный; относится к завершению на 99,9% в точке эквивалентности.
-Там должен быть обнаруживаемая конечная точка реакции, что будет лучше подтверждено индикатором.
Первичный образец
В Основные шаблоны Это вещества высокой чистоты, концентрация которых в растворе рассчитывается непосредственно из взвешенного количества и использованного объема воды.
А) Да, можно отреагировать рабочими растворами, чтобы узнать концентрации последних и перевести их в стандартные растворы.
Примеры основных шаблонов:
-Карбонат натрия (Na2CO3): Используется для стандартизации кислот, таких как серная кислота.
-Бифталат калия: это основной стандарт для приготовления стандартных растворов оснований, таких как гидроксид натрия.
-Хлорид натрия (NaCl): используется для стандартизации растворов нитрата серебра.
-Карбонат кальция (CaCO3): Первичный стандарт EDTA (этилендиаминтетрауксусная кислота).
Первичный паттерн должен соответствовать нескольким важным характеристикам:
Должен иметь Высокая чистота, Атмосферная стабильность, Отсутствие гидратационной воды, Низкая стоимость и простота получения, Y Высокий эквивалентный вес.
Классификация объемного анализа
В зависимости от химического вещества, с которым вы работаете над анализом, это будет тип волюметрии:
Кислотно-щелочной объем: Он работает с кислотой или с основанием для анализа проб, содержащих кислоты или основания.
Объем осадков: Также называемый аргентометрией, он использует стандартный раствор нитрата серебра для определения количества хлоридов в образце.
Объемность сложности: Стандартный раствор комплексообразователя, такого как ЭДТА, используется для измерения концентрации в воде жесткости, то есть карбонатов кальция и магния.
РЕДОКС объемность: Реакция происходит между окисляющим веществом и восстанавливающим веществом.
Индикаторы
Из множества индикаторов, используемых в Volumetrics, выделяются три:
1.- Метиловый апельсин: Аликвота приобретает оранжевую окраску, которую титруют кислотой. Когда точка эквивалентности будет достигнута, индикатор станет желтым.
2.- Фенолфталеин: Вначале он прозрачен в аликвоте, которая будет названа основанием. Когда точка эквивалентности будет достигнута, индикатор станет розовым.
3.- Эриохром черный: Это индикатор, используемый для определения жесткости воды. Вначале он имеет фиолетовый цвет в аликвоте, пока не будет титрован комплексообразователем. По окончании реакции он становится синим.

Инструменты для объемного анализа
В волюметрическом анализе будет использоваться ряд инструментов, которые, если они недоступны, не могут быть адекватно разработаны:
1.- Мерная колба: это контейнер, похожий на колбу в нижней части, сплющенный снизу, который имеет тонкий столбик, в который добавляется жидкость. На нем есть отметка, указывающая, где должен быть мениск жидкости, чтобы он перекрывал точный объем. Он используется для стандартных решений; благодаря точности его объема обеспечивается известная концентрация.

2.- Пипетки: это тонкие градуированные пробирки, позволяющие надежно и точно измерять количество жидкости. Они доступны до 25 миллилитров и позволяют проводить точный отбор проб.
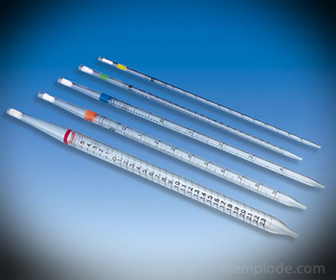
3.- Бюретка: это удлиненная трубка вместимостью 50 миллилитров, в которой будет находиться стандартный раствор. На одном из концов он имеет клапан регулирования потока, который будет сливать раствор в аликвоту.
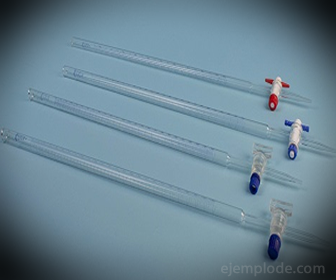
4. Колбы Эрленмейера: это емкости с плоским дном, конической формы, заканчивающейся цилиндрическим краем. Такая конструкция делает их пригодными для химического титрования, поскольку они не позволяют растворам перетекать через них. Если будет проводиться повторное тестирование, чтобы гарантировать надежный результат, потребуется минимум три.

Расчеты в объемном анализе
При работе с водными растворами важными для объемного анализа количествами являются концентрация и объем.
Основное уравнение Volumetry основано на четырех основных данных:
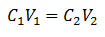
C1= Концентрация образца (неизвестно)
V1= Объем аликвоты, с которой проводился анализ
C2= Концентрация стандартного раствора, используемая для достижения точки эквивалентности
V2= Объем стандартного раствора, необходимый для завершения реакции
Данные подставляются в уравнение, оставляя неизвестной только искомую концентрацию. Конечно, все данные должны находиться на одних и тех же дисках.
Примеры объемного анализа
Определение хлоридов (Cl-) аргентометрией с нитратом серебра.
Определение бромидов (Br-) аргентометрией с нитратом серебра.
Определение цианидов (CN-) аргентометрией с нитратом серебра.
Определение карбоната магния (MgCO3) комплексометрией с ЭДТА.
Определение карбоната кальция (CaCO3) комплексометрией с ЭДТА.
Анализ серной кислоты (H2ЮЗ4) с гидроксидом натрия (NaOH).
Анализ гидроксида натрия (NaOH) с помощью соляной кислоты (HCl).
Определение сурьмы (III) перманганатом калия (KMnO4).
Определение мышьяка (III) перманганатом калия (KMnO4).
Определение титана (III) перманганатом калия (KMnO4).
Определение молибдена (III) перманганатом калия (KMnO4).
Определение железа (II) перманганатом калия (KMnO4).
Определение оксалат-иона перманганатом калия (KMnO4).