Пример органических и неорганических молекул
Химия / / July 04, 2021
В Общая химия это наука изучает все типы материи, которые существуют, и их внутренние изменения имея контакт между различными типами этого.
В Органическая химия Это раздел общей химии, предназначенный для изучения вопроса, основной составляющей которого является Углеродный элемент, Ну и что это часть живых организмов.
В Неорганическая химия Это часть общей химии, которая занимается изучением так называемых «минеральное вещество», который является частью Я не живу средой.
В Молекула это союз различные атомы разных элементов химические вещества для образования новых веществ с их особыми свойствами.
По общей химии, Элементы Являются ли чистая субстанция которые сформированы атомы одного типа. Элементы классифицируются в Периодической таблице химических элементов.
Как и он Атом - фундаментальная единица Элементов., то Молекула - основная единица Соединений, которые представляют собой вещества с характерным химическим поведением.
В Соединения может образоваться как следствие природные явления, или же
создаваться в лабораториях или в Промышленные предприятия, поэтому молекулы присутствуют везде. Молекулы находятся в минералах, в листьях деревьев, в продуктах питания, в лекарствах, в воде, которую мы пьем, в воздухе, которым мы дышим, и даже в загрязнении окружающей среды.Общая химия в основном делится на Неорганическая химия Y Химическаяк Orgпica, поэтому молекулы также можно разделить на неорганические и органические.
Неорганические молекулы
В неорганической химии молекулы в основном образованы сочетание атомов положительной валентности с другими атомами отрицательной валентности в ионных связях. Эти связи образуются в основном за счет электромагнитных сил между атомами, вызванных наличием валентных электронов.
Таким образом возникают все ионные соединения, такие как соли, оксисоли, кислоты, оксикислоты, оксиды и гидроксиды.
Неорганические молекулы как электролиты
Основное свойство ионных молекул заключается в том, что при контакте с водой H2ИЛИ ЖЕ, они разделены на две части: положительную и отрицательную. Эти две части, электрически заряженные атомы или группы атомов, диспергированы в воде. К неорганическому веществу, способному таким образом разделяться в воде, он называется электролитом.
Раствор, образованный водой и положительно и отрицательно заряженными частицами, называется «Электролитический раствор». Этот тип раствора обладает способностью проводить электрические токи, поэтому он используется в электрохимических элементах, таких как автомобильные аккумуляторы.
Неорганические кислоты и щелочные молекулы
В случае неорганических молекул, таких как Кислоты, то Оксикислоты и Гидроксиды, в то же время, когда они разделяются на положительную и отрицательную части, они вносят в Решение свойство, называемое Водородным потенциалом, измеряемым как отрицательный логарифм концентрации ионов водорода.
В Водородный потенциал (pH) определяет, насколько раствор является кислым. По шкале pH, которая колеблется от значения 1 для максимальной кислотности до 14, что соответствует полной щелочности или основности, кислотный характер находится в диапазоне от 1 до 6, а щелочной - от 8 до 14. 7 представляет нейтральный pH; ни кислотный, ни основной. Результат отрицательного логарифма концентрации H + скажет нам, где мы находимся на шкале.
Примеры кислот:
Соляная кислота: HCl: H+ + Cl-
Бромистоводородная кислота: HBr: H+ + Br-
Серная кислота: H2S: 2H+ + S-2
Синильная кислота: HCN: H+ + CN-
Соляная кислота: HI: H+ + Я-
Примеры оксикислот:
Серная кислота: H2ЮЗ4: 2H+ + ТАК4-2
Угольная кислота: H2CO3: 2H+ + CO3-2
Азотная кислота: HNO3: H+ + НЕТ3-
Фосфорная кислота: H3PO4: 3H+ + PO4-3
Хлорная кислота: HClO4: H+ + ClO4-
Примеры гидроксидов:
Гидроксид натрия: NaOH: Na+ + ОН-
Гидроксид кальция: Ca (OH)2: Ca+ + 2OH-
Гидроксид аммония: NH4ОН: NH4+ + ОН-
Гидроксид калия: КОН: К+ + ОН-
Гидроксид магния: Mg (OH)2: Mg+ + 2OH-
Неорганические молекулы в химических реакциях
Когда неорганические молекулы участвуют в химической реакции, может быть четыре основных и простых механизма реакции: Синтез, разложение, простая замена и двойная замена. Вот пример каждого:
Синтез
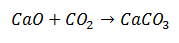
Реакция синтеза - это реакция, в которой две молекулы объединяются в конечный продукт, состоящий из одной молекулы. В примере это случай соединения оксида кальция с диоксидом углерода с образованием молекулы карбоната кальция.
Разложение:

Реакция разложения - это реакция, в которой исходная молекула разделяется на две новые стабильные молекулы. Так обстоит дело с гидроксидом кальция, который разделяется на молекулу оксида кальция и молекулу воды.
Простая замена:

В простой реакции замещения атом элемента обменивается с одним из атомов молекулы. Так обстоит дело с металлическим цинком, который занимает место водорода в хлористом водороде, высвобождая его и образуя молекулы хлорида цинка.
Двойная замена:
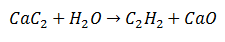
В реакции двойной замены определенные атомы двух исходных молекул обмениваются, чтобы произвести две разные молекулы как продукты. Так обстоит дело с карбидом кальция, который подвергается высвобождению углерода, который соединяется с водородом из воды с образованием ацетилена. Кальций связывается с кислородом с образованием оксида кальция в качестве второго продукта.
Органические молекулы
Органическая химия - это химия углерода, что означает, что все органические молекулы будут иметь присутствие этого элемента в различных структурных структурах.
Органические молекулы характеризуются постоянное наличие ковалентных связей. Ковалентные связи с теми, в которых два атома соединяются вместе, чтобы поделиться своими валентными электронами и, таким образом, завершить свои октеты взаимно.
Так обстоит дело с углеродом, который связывается с другими атомами того же элемента. Образуются цепочки очень разной длины, от двух до шестидесяти атомов углерода, и даже эти цепочки они разветвляются с другими цепями той же длины, достигая огромного разнообразия молекул органический.
Ионные связи также присутствуют, но они возникают на промежуточных стадиях длинных механизмов реакции, в которых образуется желаемая молекула.
Простейшие органические молекулы включают углерод и водород. Последний завершает необходимую углеродную валентность.
В органической химии молекулы могут быть линейными или алифатическими, разветвленными, циклическими и ароматическими.
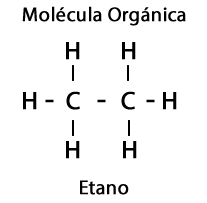
Кроме того, элементы кислород, азот, сера и фосфор участвуют в органических молекулах, что приводит к впечатляющему разнообразию функциональных групп молекул.
Функциональные группы в органических молекулах
В Функциональные группы - это группы из двух или более атомов, которые, присоединяясь к цепи углерод-водород, образуют разные химические соединения с определенным поведением.. Далее перечислены семь основных типов органических молекул с соответствующими функциональными группами. Буква «R» используется для обозначения цепи углерод-водород.
Алкилгалогениды - Форма: R-X / Функциональная группа: галогенный элемент (хлор, бром, йод)

Спирты - Форма: R-OH / Функциональная группа: -OH или гидроксил.
Альдегиды - Форма: R-CHO / Функциональная группа: -CHO, которая всегда идет в конец цепочки.
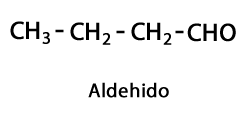
Кетоны - Форма: R-CO-R / Функциональная группа: -CO- или карбокси, всегда в среднем углероде цепи.
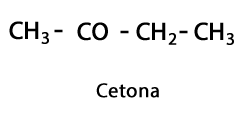
Органические кислоты - Форма: R-COOH / Функциональная группа: -COOH или карбоксил, всегда в конце цепочки.
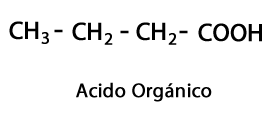
Кислотные эфиры - Форма: R-COO-R / Функциональная группа: -COO-, является результатом соединения кислотной цепи с другой цепью углерод-водород.
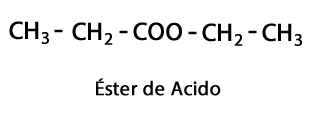
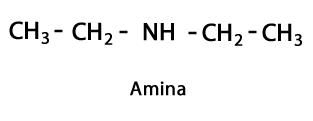
Амины - Форма: R-NH2, R-NH-R, R-N-2R / Функциональная группа: -NH2, -NH-, -N = или Amino, который представляет собой азот, дополненный водородом в местах, где нет цепи углерод-водород. Как уже говорилось, он может идти в конце цепочки или в середине. Атом азота может сопровождаться одной, двумя или тремя органическими цепями с образованием конечной молекулы. Амины можно считать органическими производными аммиака NH.3.
Органические молекулы в химических реакциях
Органические молекулы, чем длиннее их углерод-водородные цепи, тем больше участков или атомов доступно для участия в химической реакции.
Чаще всего элементы или цепи добавляются к одному из присутствующих атомов углерода, или часть основной цепи отделяется с образованием другого органического соединения.
Поскольку такие реакции требуют много времени, используются катализаторы, которые представляют собой химические агенты для ускорения реакций. В некоторых случаях катализатор представляет собой мелкую сетку из металлической платины.
Примеры неорганических молекул
Хлорид натрия NaCl
Хлорид калия KCl
Хлорид аммония NH4Cl
Нитрат натрия NaNO3
Нитрат калия KNO3
Аммиачная селитра NH4НЕТ3
Серная кислота H2ЮЗ4
Фосфорная кислота H3PO4
Фосфорная кислота H3PO3
Соляная кислота HCl
Йодоводородная кислота HI
Гидроксид натрия NaOH
Гидроксид калия КОН
Гидроксид аммония NH4ой
Гидроксид кальция Ca (OH)2
Гидроксид магния Mg (OH)2
Гидроксид железа Fe (OH)2
Гидроксид железа Fe (OH)3
Сульфид железа FeS
Сульфат железа FeSO4
Сульфат железа Fe2(SW4)3
Примеры органических молекул
Глюкоза C6ЧАС12ИЛИ ЖЕ6
Метан CH4
Этан C2ЧАС6
Ацетилен С2ЧАС2
Пропан C3ЧАС8
Бутан С4ЧАС10
Этанол C2ЧАС6ИЛИ ЖЕ
Сахароза С12ЧАС22ИЛИ ЖЕ11
Метанол CH4ИЛИ ЖЕ
Глицерин C3ЧАС8ИЛИ ЖЕ3

