Что такое электролиз
Химия / / July 04, 2021
В химии, Электролиз это явление, в котором электрический ток проходит через водный раствор ионного соединения, и начинается направить ионы (заряженные частицы) Соединения а два электрода, положительный (Анод, притягивает отрицательно заряженные анионы) и отрицательный (Катод, притягивает положительно заряженные катионы). Это явление регулируется законом электростатики, который указывает, что противоположные заряды притягиваются друг к другу.
Электролиты
В 1883 г. Майкл Фарадей обнаружил, что водные растворы одних веществ проводят электрический ток, а растворы других - нет.
Чтобы проверить, проводит ли водный раствор электрический ток, Фарадей сконструировал простой прибор, состоящий из Цепь постоянного тока 110 вольт, лампа, Y соединены два металлических или графитовых электрода к текущему источнику.
Если электроды погружены в воду, величина протекающего тока настолько мала, что лампа не загорается; то же самое верно, если их окунуть в сахарный раствор.
Напротив, если их погрузить в раствор
Хлорид натрия NaCl или из Соляная кислота HCl лампа ярко светит, что свидетельствует о том, что растворение - отличный проводник. С другой стороны, использование уксусной кислоты CH3Концентрированный COOH раствор плохо проводит ток, но когда Кислота разбавляется водой H2Или его электропроводность увеличивается.При прохождении тока через разные растворы на электродах образуются разные продукты.
В ходе своих исследований по электролизу Фарадей вывел следующие законы:
1-й закон: Количество вещества, которое подвергается химическому превращению в электроде, пропорционально количеству электричества, которое проходит через раствор.
2-й закон: Если одно и то же количество электричества проходит через разные растворы, массы веществ разложенные или осажденные на разных электродах пропорциональны эквивалентному весу указанных вещества.
Приведу пример:
Предполагается, что у вас есть пять разных электролитических ячеек. Первый с Соляная кислота HCl, второй с Сульфат меди CuSO4, третий с Хлорид сурьмы SbCl3, четвертый с Хлорид олова SnCl2 и пятый с Станнический хлорид SnCl4.
Такой же ток пропускают через серию электролитических ячеек до 1008 граммов водорода ( Эквивалентная масса водорода) раствора соляной кислоты, массы (в граммах) других продуктов, выпущенных в то же время. Они есть:
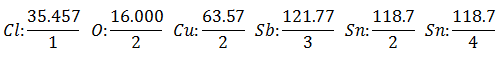
В Эквивалентный вес имеет ценность Атомный вес элемента, деленный на валенсию элемента.
Чтобы получить эквивалентный вес любого предмета, вам необходимо 96500 кулонов. Это количество электричества называется 1 Фарадей.
Единица Фарадея
Ампер определяется как однородный поток, который осаждает 0,001118 г серебра (Ag) из раствора нитрата серебра (AgNO3) через секунду. Поскольку атомный вес серебра составляет 107,88 г / моль, соотношение 107,88 / 0,001118 дает количество ампер-секунд или кулонов требуется электричество нанести химический эквивалент серебра. Это количество составляет 96494 кулонов (значение 96500 является довольно приблизительным для более простых вычислений) и называется 1 Фарадеем электричества.
Электроды
Фарадей позвонил Анод к положительному электроду и катод к отрицательному электроду. Он также создал термины анион и катион, применяемые к веществам, которые появляются соответственно на аноде и катоде во время электролиза.
В настоящее время существует другое определение электродов:
Анод: Электрод, в котором происходит потеря электронов или окисление.
Катод: Электрод, в котором происходит усиление или уменьшение электронов.
Электролиты и неэлектролиты
Проведение электрического тока через растворы не было удовлетворительно объяснено до 1887 года, когда Сванте Аррениус изложил свою теорию. Прежде чем оценить и понять теорию Аррениуса, мы сначала изложим некоторые факты, которые были известны науке, когда Аррениус сформулировал ее:
В Неэлектролитные растворы у них есть свойства, которые можно вычислить, применив закон Рауля. Давление пара и наблюдаемые точки кипения и замерзания этих растворов практически совпадают с расчетными значениями.
В Закон Рауля объясняет, что давление пара каждого растворенного вещества в растворе зависит от его собственной мольной доли в нем, умноженной на его давление пара в чистом состоянии.

Закон Рауля не работает при применении к растворам электролитов в воде. Вариации давления пара, а также точек кипения и замерзания всегда больше, чем предсказывает вышеупомянутый закон, и, кроме того, они увеличиваются при разбавлении.
Такие отклонения представлены значением i, которое представляет собой отношение отклонения, наблюдаемого в точке замерзания, к изменению, вычисленному в точке замерзания:

Значение i является мерой отклонения от закона Рауля и равно 1, когда отклонения нет.
Электропроводность электролитов
Аррениус исследовал проводимость водных растворов электролитов, чтобы выяснить, как проводимость зависит от концентрации электролита.
Он измерял молярную проводимость (которая представляет собой проводимость, соответствующую одному моль растворенного электролита; то есть удельная проводимость относилась к одному моль, и было обнаружено, что она увеличивается с разбавлением.
Аррениус сравнил свои результаты с измерениями отклонений от закона Рауля и обнаружил тесную связь между ними и молярной проводимостью. В его теории поведение электролитов объясняется:
«Молекулы электролита распадаются на электрически заряженные частицы, называемые ионами. Растворение неполное, и существует равновесие между молекулами и их ионами. Ионы проводят ток, перемещаясь в растворе ».
Отклонения от закона Рауля связаны с увеличением количества частиц в результате частичной диссоциации молекул.
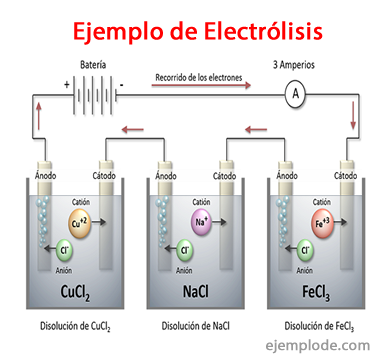
Примеры электролиза
Вот некоторые растворы, которые ведут себя как электролиты, то есть обладают способностью к электролизу:
Хлорид натрия NaCl
Соляная кислота HCl
Сульфат натрия Na2ЮЗ4
Серная кислота H2ЮЗ4
Гидроксид натрия NaOH
Гидроксид аммония NH4ой
Карбонат натрия Na2CO3
Бикарбонат натрия NaHCO3
Азотная кислота HNO3
Нитрат серебра AgNO3
Сульфат цинка ZnSO4
