Пример закона Бойля
Физика / / July 04, 2021
Изучая свойства газов, Роберт Бойл, с одной стороны, и Эдме МариоттС другой стороны, не зная и не зная своих экспериментов, они наблюдали, что газы можно сжимать, и что их объем изменяется пропорционально давлению, которому они подвергаются.
Чтобы понять его исследование, мы должны помнить, что в этом исследовании газов необходимо учитывать три характеристики: температуру, объем и давление.
Температура: это температура, при которой газ находится в условиях эксперимента. Он может быть выражен в градусах Цельсия (° C), градусах Кельвина или абсолютном нуле (° K). В случае закона Бойля считается, что температура не меняется, то есть остается постоянной.
Объем: это пространство, которое газ занимает в закрытом контейнере. Первоначально объем газа - это объем контейнера. Для его представления считается, что емкость закрытая и с поршнем, например шприцем.
Давление: это давление, которое газ оказывает через плунжер. В закрытом контейнере, на котором поршень помещен в качестве крышки, без приложения давления, считается, что он находится под атмосферным давлением (1 ат.).
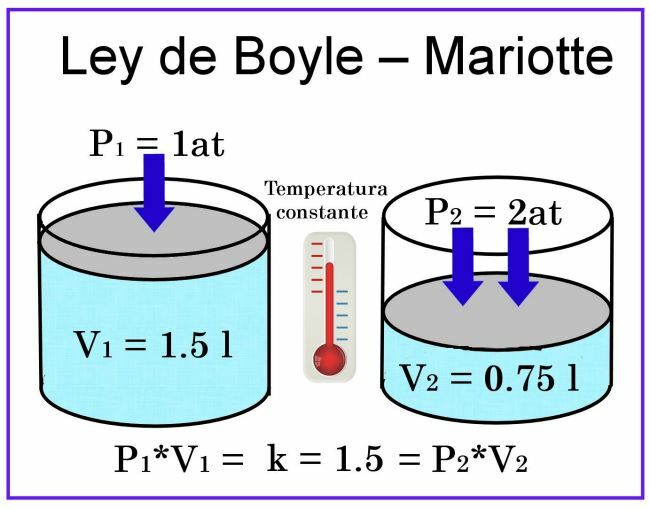
В наблюдениях Бойля и Мариотта температура считается постоянной, поэтому она не влияет на измерения.
Что касается объема, если мы рассмотрим, например, цилиндрическую емкость объемом 1 литр, а ее крышка представляет собой плунжер. раздвижной, при закрытии контейнера, наполненного воздухом, давление будет 1 ат, а объем - 1 литр. Если на поршень будет оказано давление 2 атмосферы, объем газа уменьшится вдвое, то есть до 0,5 л или 500 мл. Если давление увеличится до 4 атмосфер, объем уменьшится на четверть, то есть до 0,25 литра, или 250 мл.
На основании этих наблюдений был объявлен призыв Закон Бойля: при постоянной температуре объем газа обратно пропорционален оказываемому на него давлению.
Это означает, что когда давление увеличивается, объем уменьшается, а когда давление уменьшается, объем увеличивается.
Это позволяет установить, что существует взаимосвязь между давлением газа и его объемом, которая при изменении один из компонентов, другой изменяется в той же пропорции, соотношение остается постоянным, то есть сказать:
P * V = k
P = Давление
V = Объем
k = константа зависимости давления от объема
Чтобы понять это, предположим, что у нас есть емкость объемом 2,5 литра, которая заполнена воздухом и давление на колпачок-поршень составляет 1,5 атм. Итак, константа ваших отношений:
P * V = k = (2,5) (1,5) = 3,75
Если теперь увеличить давление до 3 атмосфер, разделим k на давление P, и мы получим:
k / P = V
3,75 / 3 = 1,25 литра
Как мы видим, при приложении двойного давления объем вдвое меньше исходного, и сохраняется постоянная зависимость давления от объема. Это выражается следующим образом:
V1п1 = V2п2 = k
То есть произведение объема 1 на давление 1 равно произведению объема 2 на давление 2, и это соотношение остается постоянным.
Примеры закона Бойля-Мариотта
Пример 1. Вычислите объем, который будет занимать газ, который занимает объем 3,75 литра, при давлении 2 атм, если к нему приложено давление 3,5 атм.
V1 = 3,75 л
п1 = 2 при
V2 = ?
п2 = 3,5 при
Поскольку V1п1 = V2п2 = k
Рассчитываем постоянную системы:
V1п1= к = (3,75) (2) = 7,5
Решаем для V2:
V2 = k / P2 = 7,5 / 3,5 = 2143 литра
Пример 2. Вычислите давление, приложенное к газу, если он занимает объем 2,25 литра, если при давлении 1,75 он имеет объем 3,25 литра.
V1 = 3,25 л
п1 = 1,75 при
V2 = 2,25 л
п2 = ?
Рассчитываем постоянную системы:
V1п1= k = (3,25) (1,75) = 5,6875
Решаем для P2:
п2 = k / V2 = 5,6875 / 2,25 = 2,53 при
Пример 3. Вычислите исходное давление газа, если при приложении давления 4,5 ат он занимает объем 1,4 литра, а его исходный объем составлял 2,2 литра.
V1 = 2,2 л
п1 = ?
V2 = 1,4 л
п2 = 4,5 при
Рассчитываем постоянную системы:
V2п2= к = (1,4) (4,5) = 6,3
Решаем для P2:
п1 = k / V1 = 6,3 / 2,2 = 2,863 при


