Пример идеального и реального газов
Физика / / July 04, 2021
А Идеальный газ тот, чьи свойства как Охватываемые давление, температура и объем, они хранят всегда пропорция или постоянные отношения между ними. Другими словами, его поведение подчиняется закону идеального газа, который представлен следующим образом:
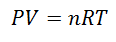
Чтобы прийти к этой формуле, начнем с La Общий закон газообразного состояния., который описывает постоянную взаимосвязь между свойствами газа в течение всего процесса. Речь идет о свойствах Давление в системе, где есть газ, Объем что занимает газ, и Температура газа.
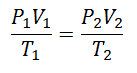
Рано или поздно было решено сформировать более простое выражение, придав постоянству букву, сопровождающую выражение:
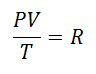
Его называли Универсальная газовая постоянная при коэффициенте R, и его значение следующее:
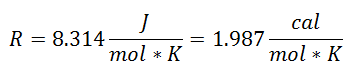
А поскольку Универсальная газовая постоянная применяется для каждого моля газа, Количество молей газа как еще один фактор, чтобы охватить все вещества, присутствующие в системе во время процесса. У нас уже будет окончательное уравнение в таком виде:
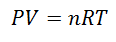
Приведенное выше уравнение
Закон идеального газаи применяется к газам с температурой от умеренной до высокой. Таким образом, любая из переменных может быть вычислена, а остальные определены.Разница между идеальными газами и реальными газами
Закон об идеальном газе не применяется для газов, находящихся на низкие температуры или близко к точке, где они станут жидкими.
Низкие температуры приводят к меньше движения частиц газа, и они будут оседать больше, занимая другой объем, чем когда они были полностью рассеяны.
Кроме того, по той же причине они будут тренировать Неравномерное давление во всей системе. Пропорциональность начнет нарушаться, и формула не будет иметь такой же достоверности для расчетов.
В этом случае следует использовать уравнения для реальных газов.
А Реальный газ тот, чьи свойства они не соответствуют в точном отношении как в Законе об идеальном газе, поэтому способ расчета этих свойств изменен.
Уравнения состояния реальных газов.
1.- Вириальное уравнение:
Для газа, который остается на Постоянная температура, соотношение между давлением и объемом или давлением и удельным объемом (объем, занимаемый каждой единицей массы газа).
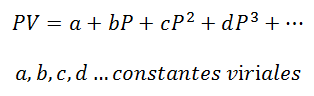
Вириальные константы - это характеристики каждого газа с конкретными значениями, которые зависят от температуры.
Можно производить только расчеты давления и объема; Температуру предварительно определяют, наблюдая за процессом. Для этих расчетов очищаются переменные вириального уравнения:
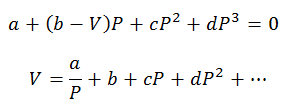
Вириальные константы для решения уравнений берутся из специализированных таблиц.
2.- УравнениеВан дер Ваальс о:
Уравнение Ван-дер-Ваальса - еще одно выражение, используемое для расчета свойств реального газа, и, как и уравнение вириала, оно также требует своих констант:

Константы также запрашиваются в таблицах.
3.- УравнениеРедли нач-Квонг:
Это уравнение очень хорошо подходит для расчетов с газами практически при любой температуре и среднем давлении, но не слишком высоких, например, в сотни атмосфер.
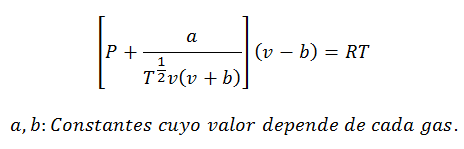
Константы также запрашиваются в таблицах.
Вы можете очистить давление, температуру и объем, чтобы произвести расчеты. Остаются зазоры:
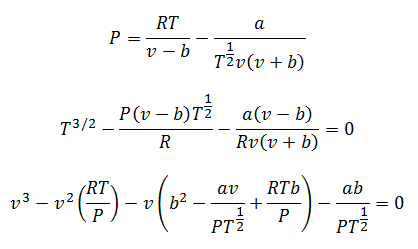
4.-Уравнение Бертло:
С помощью этого уравнения можно вычислить любую из переменных. Только у него есть два разных режима: для низкого давления и для высокого давления.
Для низкого давления:

Для высокого давления:
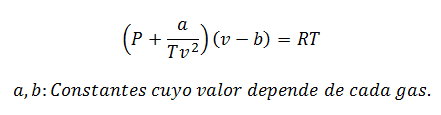
Константы также запрашиваются в таблицах.
5. -Уравнение коэффициента сжимаемости
Это уравнение представляет собой более простой вариант закона идеального газа; добавляется только коэффициент «z», называемый коэффициентом сжимаемости. Этот коэффициент получается из обобщенного графика коэффициента сжимаемости в зависимости от температуры, давления или конкретного объема, в зависимости от того, что доступно.
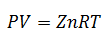
Примеры идеального и реального газов
Как идеальный или реальный персонаж Это зависит от условий давления, температуры, в которой находится газ, Невозможно составить ограниченный список, поэтому представлен список газов, который, конечно, можно найти в идеале и в реальности.
- Аммиак
- Хладагент R134 (дифтордихлорэтан)
- Углекислый газ
- Монооксид углерода
- Кислород
- Азот
- Водород
- Диоксид азота
- Трехокись азота
- Пятиокись азота
- Гептоксид диазота
- Диоксид серы
- Триоксид серы
- Хлор
- Гелий
- Неон
- Аргон
- Криптон
- Ксенон
- Метан
- Этан
- Пропан
- Бутан

