50 Príklady riešení
Rôzne / / July 04, 2021
The riešenia sú jedným z typov zmesi ktoré existujú. Zložky, ktoré tvoria roztok, nereagujú chemicky, aj keď fyzikálne vlastnosti týchto zložiek je možné upraviť, keď sa stanú súčasťou roztoku. Napríklad: dym, amalgám, káva s mliekom.
Aby bola zmes riešením, musí byť homogénny Y. uniforma, to znamená, že zmiešané zložky sa nedajú rozlíšiť voľným okom a že okrem toho pomer medzi rozpustenou látkou (látkou, ktorá sa objavuje v menšom množstve) a solventný (látka, ktorá sa objaví vo väčšom množstve) zostáva približne nezmenená v akomkoľvek objeme odobratom z roztoku. Podiel rozpustenej látky v roztoku alebo v rozpúšťadle sa označuje ako „koncentrácia“ a zvyčajne sa dá pripraviť ten istý roztok použitím rôznych koncentrácií rozpustenej látky.
Môžu vzniknúť roztoky medzi látkami, ktoré sú pred zmiešaním v ktorejkoľvek z týchto látok agregačné stavy. Riešenia existujú prakticky vo všetkých stavoch agregácie. Všeobecne je stav agregácie roztoku určený stavom agregácie rozpúšťadla. Napríklad:
Je bežné pre
prítomnosť molekúl rozpustenej látky v rozpúšťadle meniť vlastnosti samotného rozpúšťadla. Napríklad teploty topenia a varu dvoch zlúčenín sa menia, keď sa tieto zlúčeniny zmiešajú, rovnako ako ich zloženie. hustoty a farby.Francúzsky vedec Roult študoval toto chovanie komponentov v riešeniach a navrhol aj jeho hlavný zákon (Roultov zákon), ktorý uvádza, že parciálny tlak pár každej zložky v zmesi pár obklopujúci ideálne riešenie od kvapaliny rovná sa parciálnemu tlaku každej čistej zložky a jej molárnemu podielu v roztoku. Za ideálne riešenie sa považuje riešenie, v ktorom sú chemické látky veľmi podobné, takže sa neprihliada na žiadne variácie v energii interakcií medzi nimi. Základná rovnica Roultovho zákona je:
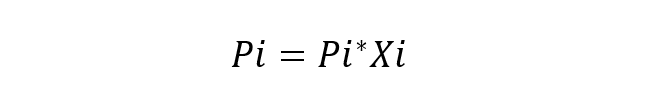
Kde:
- Pi je parciálny tlak komponentu i v plynnej zmesi obklopujúcej roztok.
- Pi * je tlak komponentu i
- Xi je molárny zlomok zložky i v rozpustení.
Je zrejmé, že ľudia sú neustále v kontakte s riešeniami. The vzduch je rozpustenie prvkov v plynný stav: jeho väčšinové zloženie je dané dusík (78%) a zvyšok je obsadených 21% kyslík a 1% ďalších zložiek, aj keď sa tieto pomery môžu mierne líšiť.
Príklady riešení
Nasledujúci zoznam obsahuje štyridsať príkladov roztokov zvýrazňujúcich stav agregácie, v ktorej sa každý z nich nachádza, rozpustenú látku v príslušnom rozpúšťadle.
- Vzduch (plyn v plyne). Zloženie plynov, kde je najviac zastúpený dusík.
- Dym (tuhá látka v plyne). Vzduch je zatuchnutý vzhľadom na dym z ohňa. Je to roztok, v ktorom vzduch pôsobí ako rozpúšťadlo.
- Zliatiny medzi kovmi (pevná látka v pevnej látke). Dural je zliatina vyrobená z hliníka, medi, mangánu, horčíka a kremíka.
- Atmosférický vzduchový prach (tuhá látka v plyne). Prítomnosť tuhých látok (rozložených takmer na nedeliteľnú jednotku, ale nakoniec tuhé látky) v plyne je príkladom rozpustenia v tomto zmysle.
- Oceľ (pevná látka v pevnej látke). Zliatina medzi železom a uhlíkom, s oveľa vyšším podielom uhlíka.
- Sýtené nápoje (plyn v kvapaline). Sýtené nápoje majú rozpustenie plynov v kvapaline.
- Amalgám (kvapalina v tuhej látke). Sú to zliatiny ortuti rozpustené v určitých kovy ako zlato alebo striebro.
- Rafinovaná ropa (kvapalina v kvapaline). Kombinácia prvkov, ktoré ju tvoria (väčšina je uhlík) vedie k rozpusteniu medzi kvapalinami.
- Bután vo vzduchu (plyn v plyne). Bután je chemická zlúčenina plynné, ktoré je možné skladovať v tubách a pripravené na použitie ako palivo.
- Kyslík vo vode oceánu (plyn v kvapaline). Okysličenie morskej vody umožňuje rozvoj vodného života.
- Nápoje s obsahom alkoholu (kvapalina v kvapaline). Ľudia ich pri oslavách veľmi konzumujú. Spravidla sú to roztoky etanolu a ovocných štiav v kontrolovaných koncentráciách alkoholu.
- Káva s mliekom (kvapalina v kvapaline). Tekutina s vyšším obsahom prijíma trochu od inej látky, čo predstavuje premenu jej farby a chute.
- Smog (plyny na plyny). Zavádzanie plynov, ktoré nie sú typické pre atmosféru, vyvoláva premenu vzduchu, ktorý má negatívne účinky na spoločnosti, ktoré to dýchajú: čím koncentrovanejšie, tým škodlivejšie to bude.
- Osolíme vo vode (tuhá látka v tekutine). Široko používaný na varenie.
- Krv (kvapalina v kvapaline). Hlavnou zložkou je plazma (kvapalina) a v nej sa objavujú ďalšie prvky, medzi ktorými vynikajú červené krvinky.
- Amoniak vo vode (kvapalina v kvapaline). Toto riešenie (ktoré je možné vyrobiť aj z plynu na kvapalinu) je funkčné pre mnoho čistiacich prostriedkov.
- Vzduch so stopami vlhkosti (kvapalina v plyne). Vodná para je vo vzduchu prítomná kvôli zvýšenému obsahu teplota.
- Šťavy z prášku (tuhá látka v tekutine). Prášok sa rozpúšťa vo vode a vytvára roztok farby práškovej šťavy.
- Vodík v paládiu (plyn v tuhom skupenstve). Vodík sa veľmi dobre rozpúšťa v niektorých kovoch.
- Vzdušné vírusy (tuhá látka v plyne). Rovnako ako atmosférický prach sú to veľmi malé jednotky tuhej látky, ktoré sa prenášajú plynom.
- Ortuť v striebre (kvapalina v tuhej látke). Je to jeden z takzvaných „amalgámov“.
- Čaj (tuhá látka v tekutine). Na vode sa rozpustí tuhá látka vo veľmi malých rozmeroch (granity obalu).
- Kráľovská voda (kvapalina v kvapaline). Je to zloženie kyselín čo umožňuje rozpúšťanie rôznych kovov, medzi ktorými sa objavuje zlato.
- Bronz (pevná látka v pevnej látke). Je to zliatina medi a cínu.
- Limonáda (kvapalina v kvapaline. Aj keď je zmes mnohokrát medzi pevnou látkou a kvapalinou, v skutočnosti je to kvapalina prítomná v tejto pevnej látke, napríklad citrónová šťava.
- Peroxid (kvapalina v kvapaline). Je to roztok peroxidu vodíka (H2ALEBO2) vo vode. Používa sa na dezinfekciu rán a v kozmetickom priemysle.
- Mosadz (pevná látka v pevnej látke). Je to zliatina medzi pevnou meďou a zinkom.
- Chladenie ľadom (tuhá látka v tekutine). Ľad vstupuje do kvapaliny a počas rozpúšťania ju ochladzuje. Ak sa pridáva do vody, ide o konkrétny prípad, keď ide o rovnakú látku.
- Fyziologické riešenie (kvapalina v kvapaline). Voda pôsobí ako rozpúšťadlo a veľa kvapalných látok pôsobí ako rozpustená látka.
- Smoothies (pevné látky v kvapalinách). Procesom mletia sa indukuje kombinácia pevných látok s kvapalinami.
Postupujte podľa:



