20 Príklady alkánov
Rôzne / / July 04, 2021
The alkány sú akési uhľovodíky v ktorých je premenlivý počet atómov uhlíka spojený jednoduchými väzbami, ako je napríklad kostra, a každý atóm uhlíka je postupne spojený s atómami vodíka, ktoré môžu byť nakoniec nahradené inými atómy alebo funkčné skupiny. Napríklad: chloroform, metán, oktán.
The molekulárny vzorec alkánov otvoreného lineárneho reťazca je CnH2n + 2, kde C predstavuje uhlík, H predstavuje vodík a n predstavuje počet atómov uhlíka. Alkány sú nasýtené uhľovodíky, čo znamená, že nemajú dvojité alebo trojné väzby. Na ich pomenovanie použijete prípona „-Ano“ po pomenovaní uhlíkového reťazca pomocou predpona čo zodpovedá počtu atómov uhlíka (et- (2), pro- (3), but- (4), pen- (5), hex- (6), hep- (7) atď.).
Môže vám slúžiť:
Klasifikácia alkánov
V alkánoch sú zvyčajne rozpoznávané dve veľké skupiny: otvorený reťazec (nazývaný tiež acyklický) a uzavretý reťazec (alebo cyklický).
Keď zlúčeniny s otvoreným reťazcom Nepredstavujú žiadnu substitúciu vodíkov, ktoré sprevádzajú každý atóm uhlíka, nazývajú sa lineárne alkány: jedná sa o najjednoduchšie alkány. Ak predstavujú substitúciu ktoréhokoľvek zo svojich vodíkov jedným alebo viacerými uhlíkovými reťazcami, hovorí sa im rozvetvené alkány. Najbežnejším substituentom sú etylové skupiny (CH
3CH2-) a metyl (CH3-).Pokiaľ ide o časť, existujú zlúčeniny s jedným cyklom v molekule (monocyklické) a ďalšie s niekoľkými (polycyklickými). The cyklické alkány môžu byť homocyklické (vznikajú výhradným pôsobením atómov uhlíka) alebo heterocyklické (na ktorých sa podieľajú ďalšie atómy, napríklad kyslík alebo síra).
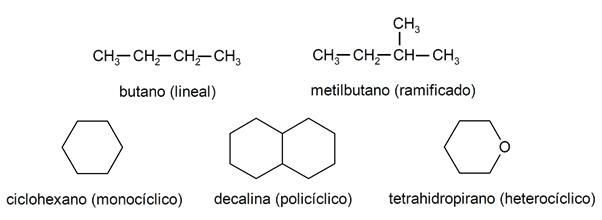
Fyzikálne vlastnosti alkánov
Všeobecne, fyzikálne vlastnosti alkánov sú podmienené molekulovou hmotnosťou (zase spojenou s dĺžkou uhlíkového reťazca). Tie s najmenším počtom uhlíkov sú plynný do teplota v rozmedzí od 5 do 18 atómov uhlíka kvapalinya nad týmto počtom sú pevný (podobne ako vosk).
Pretože sú menej husté ako voda, majú tendenciu sa na nej vznášať. Alkány sú všeobecne nerozpustné vo vode a rozpustné v organických rozpúšťadlách.
Bod z vriaci a z fúzia alkánov závisí od ich molekulová hmotnosť, to znamená na dĺžke uhlíkového reťazca, aj keď tiež mnohokrát závisia od priestorového usporiadania atómov. Lineárne a cyklické alkány majú vyššie teploty varu ako rozvetvené.
Chemické vlastnosti alkánov
Alkány sa vyznačujú tým, že sú chemické zlúčeniny veľmi zlá reaktivita, a preto sú tiež známe ako „parafíny“ (v latinčine parum affinis znamená „nízku afinitu“). Sú to zlúčeniny, ktoré majú veľmi vysokú aktivačnú energiu, keď sú zapojené do chemické reakcie. Najdôležitejšou reakciou, ktorú môžu alkány podstúpiť, je spaľovanie za prítomnosti kyslíka, tepla, oxidu uhličitého a vody.
Alkány sú základom pre dôležitú škálu reakcií spojených s priemyselné procesy veľmi dôležité, pretože ide o najtradičnejšie palivo. Objavujú sa tiež ako konečné produkty biologických procesov, ako je napríklad metanogénna fermentácia, ktorú niektorí vykonávajú mikroorganizmy.
Príklady alkánov
Niektoré príklady alkánov (vrátane niektorých známych lineárnych a rozvetvených) sú:
- Chloroform (vymyslený názov trichlórmetán; CHCI3). Výpary tejto látky sa zvykli používať ako anestetiká. Z tohto dôvodu bola ukončená, pretože sa zistilo, že je poškodená orgánov dôležité ako pečeň alebo obličky. Dnes sa používa predovšetkým ako rozpúšťadlo alebo chladivo.
- Metán (CH4). Je to najjednoduchší alkán zo všetkých: je tvorený iba jedným atómom uhlíka a štyrmi atómami vodíka. Je to plyn, ktorý sa prirodzene vyskytuje pri rozklade rôznych organických substrátov a je hlavnou zložkou zemného plynu. V poslednej dobe bol uznaný ako jeden z plynov, ktorý najviac prispieva k takzvanému skleníkovému efektu.
- Oktán (C.8H18). Je to osemuhlíkový alkán a má veľký význam, pretože určuje konečnú kvalitu ťažkého benzínu, čo je zmiešať rôznych uhľovodíkov. Táto kvalita sa meria oktánovým alebo oktánovým číslom paliva, ktoré berie ako referenciu nízko detonujúci (index 100) a vysoko detonujúci (index 0).
- Hexán (C.6H14). Je to dôležité rozpúšťadlo, je potrebné sa vyhnúť jeho vdýchnutiu, pretože je veľmi toxický.
- Bután (C.4H10). Spolu s propánom (C.3H8), tvoria takzvané skvapalnené ropné plyny (LPG), ktoré sa tvoria v plynových vakoch počas procesu ťažby oleja. V súčasnosti sa podporuje výmena benzínu alebo nafty za LPG ako paliva ekologickejšieho uhľovodíka (počas spaľovania vydáva iba oxid uhličitý a vodu).
- Icosano (C.20H42). Jedná sa o dvadsať uhlíkový alkán (predpona „ico“ znamená dvadsať)
- Cyklopropán (C.3H6). Predtým sa používal ako anestetikum
- n-heptán (C.7H16). Je to ten, ktorý sa berie ako referencia pre nulový bod stupnice benzínového oktánu, čo by bolo najmenej žiaduce, pretože horí výbušne. Získava sa zo živice určitého druhu rastlín.
- 3-etyl-2,3-dimetylpentán (C.9H20)
- 2-metylbután (C.5H12)
- 3-chlór-4-n-propylheptán (C.10H21Cl)
- 3,4,6-trimetylheptán (C.10H22)
- 1-bróm-2-fenyletán (C.8H9Br)
- 3-etyl-4-metylhexán (C.9H18)
- 5-izopropyl-3-metylnonán (C.13H28)
- Kubánsky (C.8H8)
- 1-brómpropán (C.3H7Br)
- 3-metyl-5-n-propyloktán (C.12H26)
- 5-n-butyl-4,7-dietyldekán (C.18H28)
- 3,3-dimetyldekán (C.12H26)
