100 príkladov chemických prvkov
Rôzne / / November 13, 2021
The chemické prvky sú typom vecí, ktoré žiadnym postupom resp chemická reakcia možno ich zmenšiť alebo rozložiť na iné jednoduchšie prvky. Z tohto dôvodu možno povedať, že prvok je všetko záležitosť vytvorené atómov rovnakej a jedinečnej triedy, teda atómy, ktoré majú rovnaké atómové číslo (rovnaký počet protónov), hoci majú rôznu atómovú hmotnosť. Napríklad: síra, bór, chróm, cín.
Prvú definíciu chemického prvku zaviedol r Lavoisier pri Traite Élémentaire de Chimiev roku 1789. V 18. storočí Lavoisier rozdelil jednoduché látky do štyroch skupín:
Periodická tabuľka prvkov
Dnes sa poznajú 118 chemických prvkov. Všetky sú zhromaždené, klasifikované a usporiadané podľa mnohých ich vlastností v grafickej schéme známej ako Periodická tabuľka prvkov, ktorú pôvodne vytvoril ruský chemik. Dimitrij Mendelejev v roku 1869. Periodická tabuľka sa skladá z 18 skupín (stĺpcov) a 7 období (riadkov), v ktorých sa nachádzajú chemické prvky.
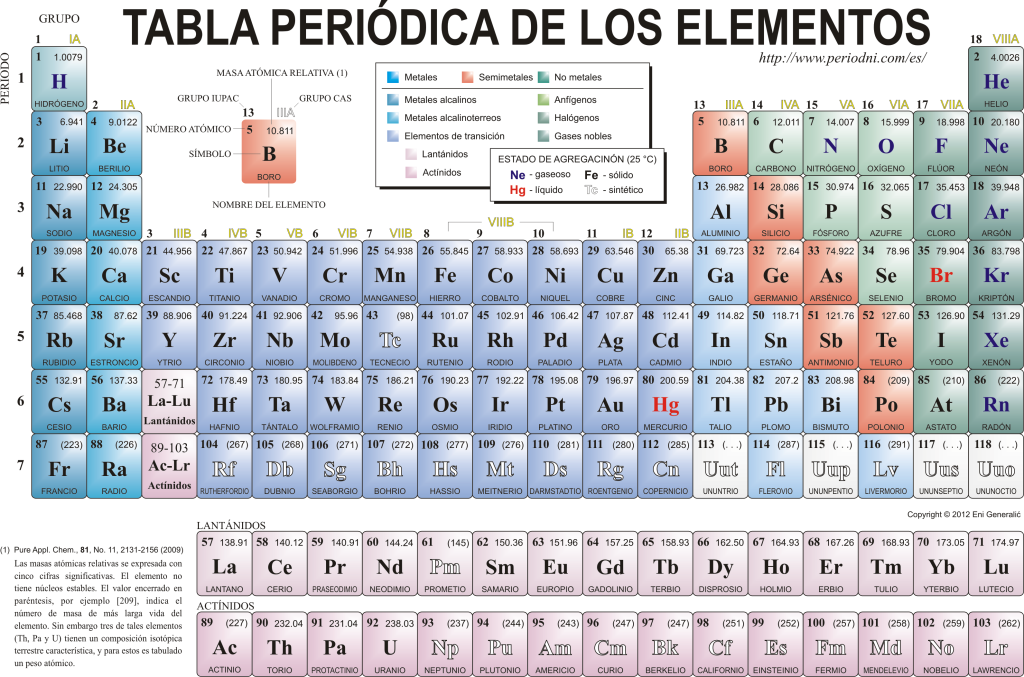
The hlavné skupiny ktoré nájdete v tejto tabuľke sú:
Alkalické kovy (skupina 1), kovy alkalických zemín (skupina 2), skupina skandia, ktorá zahŕňa zeminy a aktinidy (skupina 3), skupina titánu (Skupina 4), rodina vanádu (Skupina 5), rodina chrómu (Skupina 6), rodina mangánu (Skupina 7), rodina železa (Skupina 8), rodina kobaltu (Skupina 9), skupina niklu (skupina 10), skupina medi (skupina 11), skupina zinku (skupina 12), prvky zeminy (skupina 13), karbonidové prvky, v tejto skupine sú Uhlík, ktorý tvorí základ života na Zemi (skupina 14), prvky tvoriace dusík (skupina 15), amfigenetické prvky, zahŕňa kyslík, základný prvok pre a dýchanie z živé bytosti (Skupina 16), halogénové prvky (Skupina 17) a vzácne plyny (Skupina 18).
Mnohé z týchto prvkov majú stabilné alebo rádioaktívne izotopy, to znamená, že ten istý chemický prvok, napríklad vodík (H), môže mať niekoľko izotopov (1H, 2H, 3H). To znamená, že každý atóm izotopu má rovnaký počet protónov (čo znamená, že patrí rovnakému chemickému prvku) a rôzny počet neutrónov.
Niektoré izotopy nie sú stabilné (rádioaktívne), tj. rozpadnúť sa v určitom čase emituje určité častice (okrem iného neutróny, fotóny, častice alfa) a vytvára ďalšie stabilné alebo rádioaktívne izotopy. Chemické prvky majú vlastnosti ako bod vriaci a to z fúzia, elektronegativita, hustota a iónový polomer, medzi inými. Tieto vlastnosti sú dôležité, pretože nám umožňujú predpovedať jeho správanie, reaktivitu atď.
Ako sú prvky prezentované v periodickej tabuľke?
Každý chemický prvok je charakterizovaný v Periodická tabuľka pomocou určitej symboliky. V prvom rade je v strede každého políčka jeho univerzálny symbol, ktorý pozostáva z jedného alebo dvoch písmenami (podľa konvencie, ak sú dve písmená, prvé sa píše veľkými a ďalšie malými).
Hore a vľavo sa zobrazuje malým typom písma su atómové číslo, čo je ten, ktorý udáva množstvo protónov, ktoré tento prvok má. Pod symbolom prvku sa zobrazí jeho názov a nad ním vľavo sa zobrazí jeho názov. atómová hmotnosť príbuzný. Okrem toho farba, v ktorej je symbol prvku znázornený, označuje jeho stav agregácie (podľa znázornenia použitého v každej periodickej tabuľke).
Prítomné rôzne prvky atómové polomery premenné a ako sa zvyšuje počet protónov v jadre, tým väčšia je príťažlivosť, ktorú jadro pôsobí na elektróny, takže polomer atómu má tendenciu klesať. Keď je atómový polomer malý, elektróny na najvzdialenejšej úrovni oblaku sú veľmi priťahované k jadru, takže sa ľahko nevzdávajú. Pri prvkoch s vysokými atómovými polomermi je to naopak: ľahko sa vzdávajú svojich vonkajších elektrónov.
Atómový polomer sa teda zväčšuje zhora nadol, keď prechádzame skupinami periodickej tabuľky a klesá zľava doprava, keď prechádzame ich periódami.
Príklady chemických prvkov
| Chemický prvok | Symbol |
| aktinium | Ac |
| hliník | K |
| Americium | A.M |
| Antimón | Sb |
| argón | Ar |
| Arzén | Eso |
| Astat | o |
| Síra | S |
| bárium | Ba |
| Berýlium | byť |
| Berkelium | Bk |
| bizmut | Bi |
| Bohrio | Bh |
| bór | B |
| bróm | Br |
| kadmium | CD |
| Vápnik | AC |
| Kaliforniu | Porov |
| Uhlík | C |
| Cerium | EC |
| Cézium | Čs |
| Chlór | Cl |
| kobalt | spol |
| Meď | Cu |
| Chrome | Cr |
| Curium | Cm |
| Darmstadio | Ds |
| Dysprosium | D Y |
| Dubnium | Db |
| Einsteinium | to je |
| Erbium | Er |
| Scandium | Sc |
| Cín | Sn |
| stroncium | Pán |
| európium | EÚ |
| Fermium | Fm |
| Fluór | F |
| Zápas | P |
| Francius | O |
| Gadolínium | Gd |
| Gálium | Ga |
| Germánium | Ge |
| hafnium | Hf |
| Hassio | Hs |
| hélium | mám |
| Vodík | H |
| železo | Viera |
| Holmium | Ho |
| indický | In |
| jód | ja |
| Iridium | Ísť |
| Ytterbium | Yb |
| Ytrium | A |
| Krypton | Kr |
| Lantán | The |
| Lawrencio | Lr |
| Lítium | Li |
| lutécium | Po |
| horčík | Mg |
| mangán | Mn |
| Meitnerius | Mt |
| Mendelevium | Md |
| Merkúr | Hg |
| molybdén | Mo |
| Neodym | Na |
| Neon | Nie |
| Neptúnium | Np |
| niób | Pozn |
| nikel | Ani jedno |
| Dusík | N |
| Nobelio | nie |
| Zlato | Au |
| Osmium | vy |
| Kyslík | ALEBO |
| paládium | P.S |
| Strieborná | Ag |
| Platina | Pt |
| Viesť | Pb |
| Plutónium | Pu |
| polónium | Po |
| Draslík | K |
| Prazeodym | Pr |
| Sľub | Popoludnie |
| Protaktínium | Pa |
| Rádio | Ra |
| Radón | Rn |
| rénium | Re |
| Rhodium | Rh |
| Rubidium | Rb |
| ruténium | Ru |
| Rutherfordio | Rf |
| Samárium | Áno |
| Seaborgio | Sg |
| Selén | viem |
| kremík | Áno |
| Sodík | Na |
| Tálium | Tl |
| tantal | Ta |
| technécium | Tc |
| Telúr | Čaj |
| Terbium | Tb |
| titán | vy |
| Tórium | Th |
| Thulium | Tm |
| Koperníka | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Unuoctium | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrium | Uut |
| Urán | ALEBO |
| Vanád | V |
| Volfrám | W |
| xenón | Xe |
| Zinok | Zn |
| Zirkónium | Zr |

Nasledujte s:
