Definícia molekulárnej geometrie
Rôzne / / January 11, 2022
Koncepčné vymedzenie
Je to štruktúra molekuly, ktorá určuje trojrozmerné usporiadanie atómov, ktoré ju tvoria v priestore.

Chemický inžinier
Molekulové geometrie sú v súčasnosti definované na základe teória odpudzovania elektronických párov vrstvy Valencia (TRPECV). Táto teória umožňuje predpovedať správanie chemický látok (konkrétne kovalentných) a pomáha pochopiť distribúcia elektronika, čo vedie k geometria z molekula. To nám zase umožňuje pochopiť mnohé vlastnosti, ktoré látky získavajú.
Táto teória je založená na sérii základných pilierov, ktoré preskúmame a potom sa pokúsime ich pochopiť aplikácie prax. V prvom rade sa viazané a neviazané (valenčné) elektróny považujú za more elektrónov, ktoré majú rovnaký typ náboja, navzájom sa odpudzujú, takže budú vždy umiestnené čo najďalej od centrálneho atómu molekula.
Po druhé, toto „more“ elektrónov alebo „elektronický oblak“ tvorí oblasti s vysokou hustotou elektrónov, ktoré sú vytvorené vo väzbách, kde sú elektróny zdieľané alebo v pároch elektrónov nezdieľaných. Na druhej strane môžu byť vytvorené väzby jednoduché, dvojité alebo dokonca trojité.
Nakoniec pre rozhodnúť molekulárnej geometrie, je veľmi užitočné mať Lewisovu štruktúru, kde sa bude počítať množstvo elektrónových hustôt okolo centrálneho atómu, čo poskytne indikáciou z názvu jej geometrie a tvaru, ktorý molekula nadobúda trojrozmerne.
Je potrebné poznamenať, že tieto hustoty budú umiestnené čo najďalej od seba, aby sa prijala najstabilnejšia štruktúra a kde je menšie odpudzovanie. Takto sa najprv identifikuje elektronická geometria a potom molekulárna geometria.
Šesť úrovní hustoty
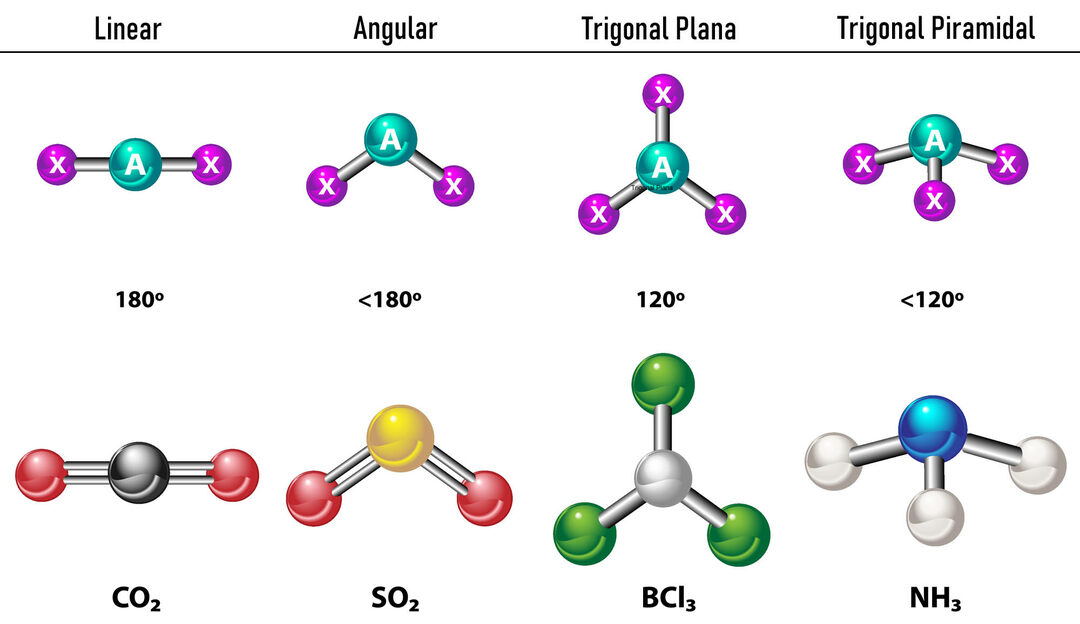
V prípade, že sú okolo centrálneho atómu dve elektrónové hustoty, väzby budú umiestnené čo najďalej od seba medzi nimi, to znamená 180° od seba, a preto je ich elektronická geometria lineárna a molekulárne je tiež lineárna.
V prípade, že okolo centrálneho atómu sú tri elektrónové hustoty, existujú dve možnosti: tri väzby alebo dve väzby a jeden neviazaný pár. Ak existujú tri väzby, elektronická geometria je Trojuholníkový byt, so 120º uhlami medzi väzbami a molekulárna geometria má rovnaký názov. Teraz, ak existuje nespojený pár, odpudzujú sa navzájom ďalšími intenzita že viazané náboje majú preto tendenciu stláčať väzbové uhly. Uhol medzi voľným párom a každou väzbou je 120º a elektronická geometria je trigonálna rovina, zatiaľ čo molekulárna geometria je uhlová.
V prípade, že okolo centrálneho atómu sú štyri elektrónové hustoty, elektrónová geometria je tetraedrická. Ak sú všetky štyri páry elektrónov viazané, ich molekulárna geometria sa v názve zhoduje s ich elektronickou geometriou a väzbový uhol je 109,5º. Teraz, ak je jeden z párov voľný, väzbový uhol sa zmenší (107º) a molekulárna geometria je typ Trigonálna pyramída. Nakoniec, ak sú dva voľné páry a dva sú spojené, väzbový uhol je 104,5º, zatiaľ čo molekulárna geometria sa nazýva Hranatý.
Keď hustota elektrónov okolo centrálneho atómu dosahuje päť, nazýva sa to a Trigonálna bipyramída jeho elektronická geometria. Ak sú všetky zaťaženia spojené, medzi rovníkovými spojmi sú uhly 120°C a medzi axiálnymi a rovníkovými uhly 90°. Teraz sa molekulárna geometria nazýva aj trigonálna bipyramída, zatiaľ čo so štyrmi spojenými pármi a jedným voľným párom je molekulárna geometria skreslená a vytvára dobre známy „rocker“, Tam je názov, ktorý získava Skreslený štvorsten. Zatiaľ čo ak sú dva z piatich párov elektrónov voľné a tri z nich sú spojené, má geometriu v tvare písmena „T“ a jeho názov je práve kvôli jeho štruktúre. Nakoniec, ak je to naopak, tri voľné páry a dva viazané náboje, molekulárna geometria je lineárna.
Nakoniec je okolo centrálneho atómu šesť elektrónových hustôt a vytvorí sa oktaedrón, odtiaľ jeho názov v elektronickej geometrii. Podobne je pomenovaná molekulárna geometria, ak sú všetky jej páry spojené. Ak máte päť spojených párov a jeden voľný pár, molekulárna geometria je štvorcová základná pyramída. Ak máte štyri viazané páry a dva voľné páry, molekulárna geometria je Štvorcový byt.
Obrázok: Sladká príroda
Témy molekulárnej geometrie