Pojem v definícii ABC
Rôzne / / April 22, 2022
definícia pojmu
Azeotropy sú zmesi chemických zlúčenín s definovaným zložením, ktoré vrú pri určitých teplotách. Základnou charakteristikou je, že zmes sa správa ako jedna čistá látka, zachováva si svoje vlastnosti a uľahčuje manipuláciu.

Chemický inžinier
Zmes môže byť daná dvoma alebo viacerými zložkami a jeho zloženie je rovnaký v kvapalnej aj plynnej fáze, čo vytvára podobnosti s čistými látkami. Z toho sa dá ľahko odvodiť, že táto zmes sa nedá rozdeliť na jej zložky procesmi ako napr frakčné destilácie, pretože, ako je uvedené vyššie, zachová si svoje proporcie a bude sa správať ako keby išlo o jeden komponent.
Ďalšou charakteristikou je, že bod varu tejto zmesi môže byť vyšší, nižší alebo dokonca rovnaký ako bod varu jednej z jej zložiek. Keď azeotrop vrie pri a teplota maximálneho varu, je známy ako maximálny azeotrop, a keď tak robí pri najnižšej možnej teplote, je známy ako minimálny azeotrop. To znamená, že minimálny azeotrop má nižšiu teplotu varu ako jeho čisté zložky a naopak s maximálnym azeotropom. Napríklad v zmesi metanol - benzén je azeotrop minimum (0,61 benzénu - 0,39 metanolu vo frakciách molárny), ktorého bod varu je 58 °C, v nádrži, kde je bod varu benzénu 80 °C a metanolu 65 °C
Minimálne a maximálne azeotropy
Teraz... odkiaľ pochádza azeotrop? Keď dôjde k odchýlke od zákon Raoult, to znamená, že tlak pár azeotropnej zmesi priamo nesúvisí s jej molárnym zlomkom, práve vtedy vzniká pojem azeotropná zmes. Tieto odchýlky sa vyskytujú, keď sa zložky navzájom výrazne priťahujú alebo odpudzujú, to znamená, že medzimolekulové sily sú v rôznych zlúčeninách veľmi odlišné.
Keď je odchýlka kladná, máme minimálny azeotrop, zatiaľ čo ak je odchýlka záporná, máme maximálny azeotrop. Pre lepšie pochopenie tohto konceptu sa pozrime na niektoré grafiky:
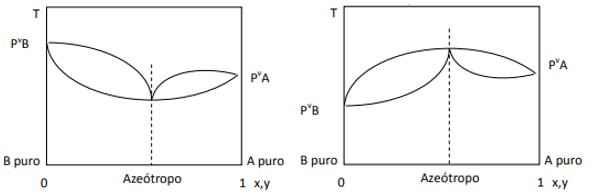
Tu pozorujeme, že ak by zmes bola ideálna, podľa Raoultovho zákona by tlaky pár čistých zložiek mali byť spojené priamkou, pretože existuje odchýlka od tohto zákona, ktorá spôsobuje tvorbu minimálnych a maximálnych azeotropov v závislosti od toho, či medzi nimi existuje väčšia alebo menšia afinita. komponentov. Keď je odchýlka od Raoultovho zákona záporná, ako na obrázku vľavo, je minimálna diagram tlaku, ale maximum v teplotnom diagrame (teda azeotrop maxima). Na druhej strane, ak je odchýlka kladná voči Raoultovmu zákonu, bude to maximum v tlaku vs. zloženie, ale minimum v diagrame teplota vs. zloženie (tu máme minimálny azeotrop). Nepleťte si diagramy tlak vs. zloženie a teplota vs. zloženie.
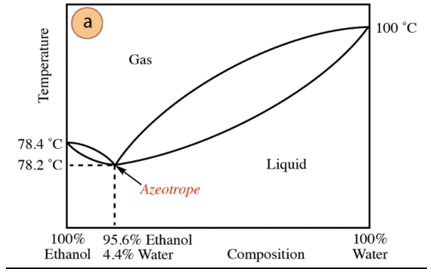
V prípade zmesi etanol-voda existuje minimálny azeotrop, ktorého zloženie je 95,6 % etanolu a 4,4 % vody. Teplota varu azeotropnej zmesi je o 78,2 °C nižšia ako teplota varu čistých zložiek. Predpokladajme teda, že destilujete zmes vody a etanolu s vysokým obsahom vody (takmer 100 %). Nebude možné získať čistý alkohol, pretože v každom stupni destilácie sa získajú väčšie frakcie. etanolu, ale nikdy nedosiahne 100 %, postupne sa bude približovať k zloženiu azeotropnej zmesi (najnižší bod pod). Preto má podobne ako voda tendenciu vytvárať minimálne azeotropy Organické zlúčeniny (vzhľadom na typ intermolekulárnych síl, ktoré interagujú), je potrebné vopred odstrániť vodu zo zmesi, aby sa získala čistá zlúčenina. Alebo, akonáhle sa získa azeotrop, spôsoby extrakcia dodatočnej vody.
Na základe vyššie uvedeného nie je náhoda nájsť alkohol (v supermarkete a LEKÁREŇ) na 95% je najlacnejším produktom, ktorý je možné získať. Na získanie čistého alkoholu je potrebné „rozbiť“ azeotrop s technika ďalšie, ako je použitie sušiacich činidiel alebo azeotropických destilácií. Azeotropická destilácia pozostáva z pridania ďalšej zložky do zmesi, ktorá pôsobí strhávaním a pomocou interakcia s niektorou zo zložiek zmesi (vyššia afinita) môžu byť zo zmesi odstránené.
Témy v azeotropoch


