30 Príklady alkoholov
Príklady / / November 06, 2023
The alkoholy sú organické chemické zlúčeniny ktoré vo svojej štruktúre obsahujú hydroxylovú funkčnú skupinu (-OH) pripojenú k uhlíku (-C). Skupina (- C – OH) sa nazýva „karbinol“. Niektoré príklady alkoholov sú: metanol, etanol a 1-propanol.
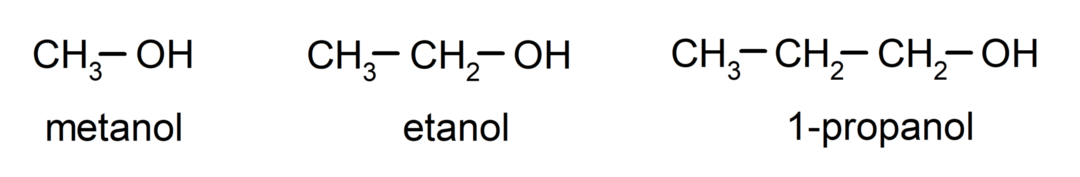
Alkoholy sú chemické zlúčeniny s rôznym využitím v každodennom živote, pretože majú antibakteriálne a antiseptické vlastnosti. Na druhej strane môžu byť pri nekontrolovanom požití nebezpečné pre ľudské zdravie.
Rovnako nie všetky alkoholy môžu ľudia požiť.
- Pozri tiež: Amíny a ketóny
Druhy alkoholov
V závislosti od počtu atómov uhlíka, ku ktorým je pripojený atóm uhlíka, ku ktorému je pripojená hydroxylová skupina, môže byť alkohol:
- Primárny alkohol. Atóm uhlíka, ku ktorému je pripojená hydroxylová skupina, je tiež pripojený k jedinému atómu uhlíka. Napríklad:
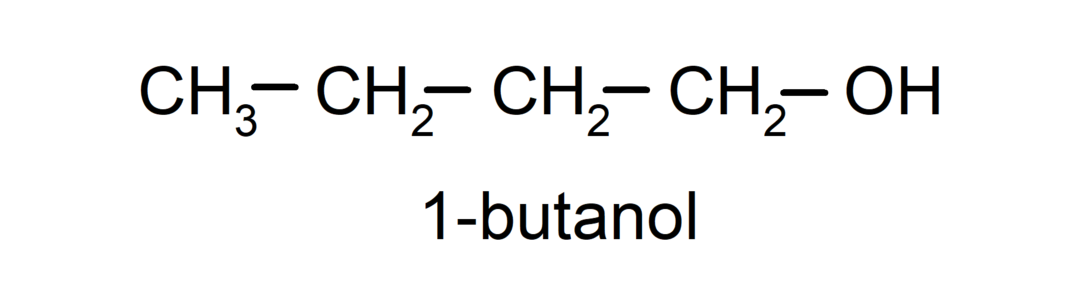
- Sekundárny alkohol. Atóm uhlíka, ku ktorému je pripojená hydroxylová skupina, je tiež viazaný na dva ďalšie atómy uhlíka. Napríklad:
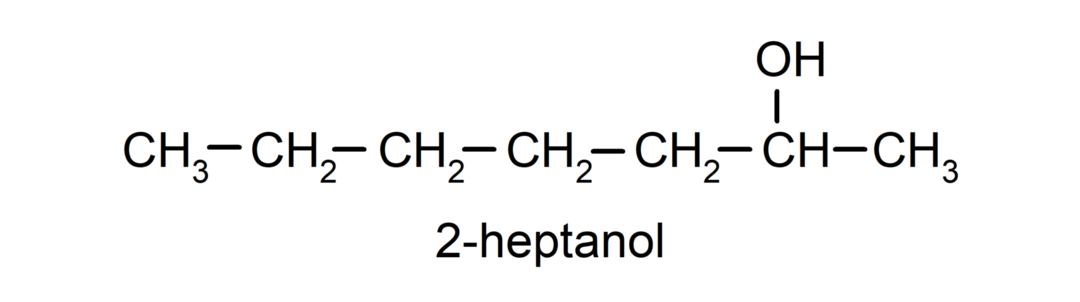
- Terciárny alkohol. Atóm uhlíka, ku ktorému je pripojená hydroxylová skupina, je tiež pripojený k trom atómom uhlíka. Napríklad:
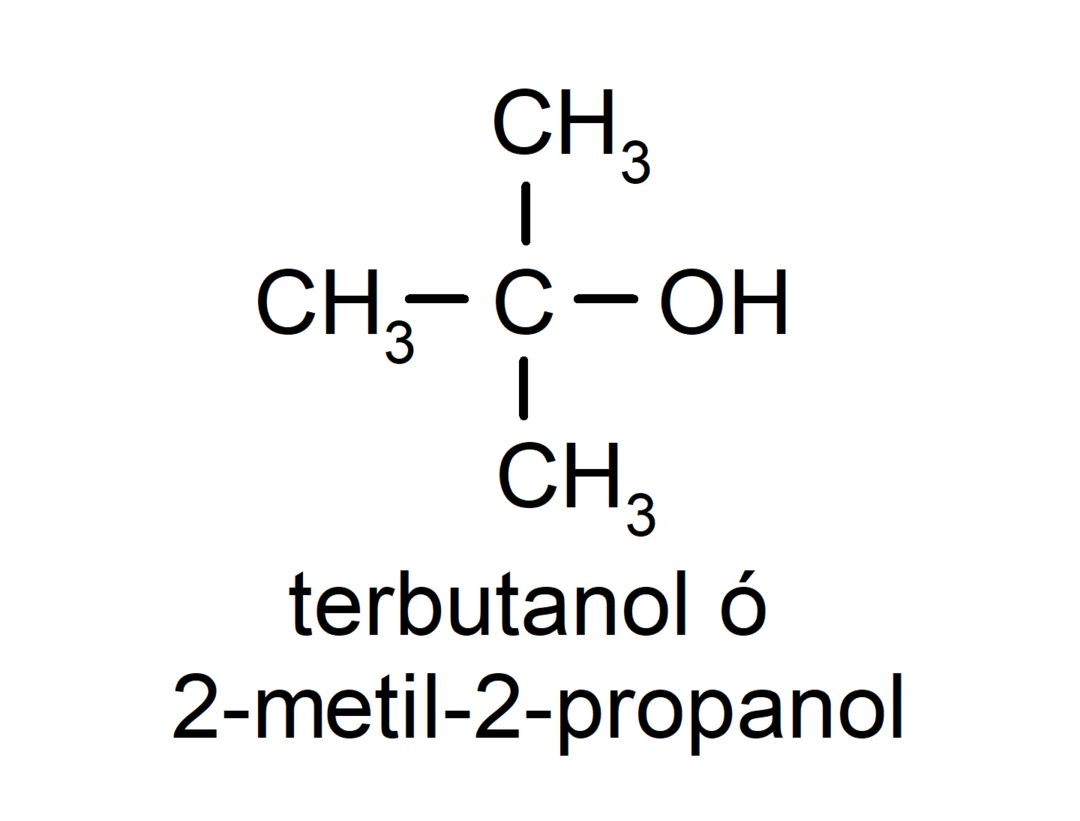
V závislosti od počtu hydroxylových skupín, ktoré má, môže byť alkohol:
- Diol. Vo svojej štruktúre má dve hydroxylové skupiny. Napríklad:
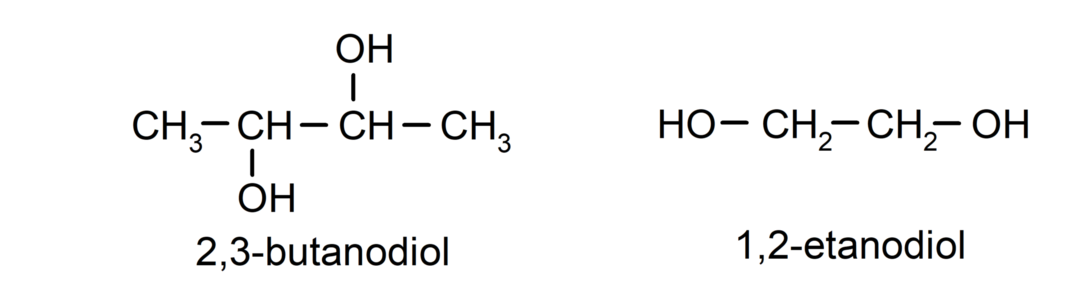
- Triol. Vo svojej štruktúre má tri hydroxylové skupiny. Napríklad:
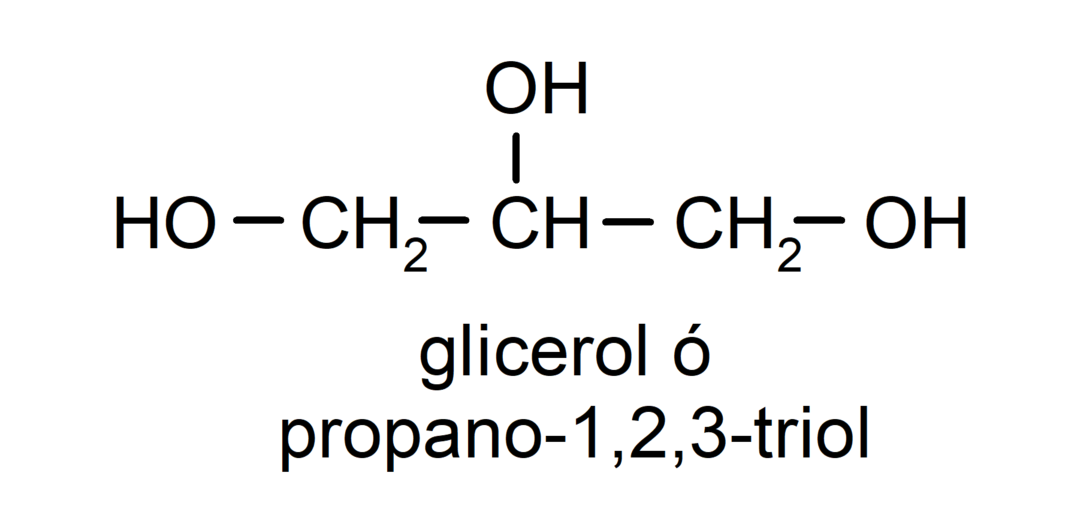
- Polyalkohol. Vo svojej štruktúre má veľa hydroxylových skupín. Napríklad:
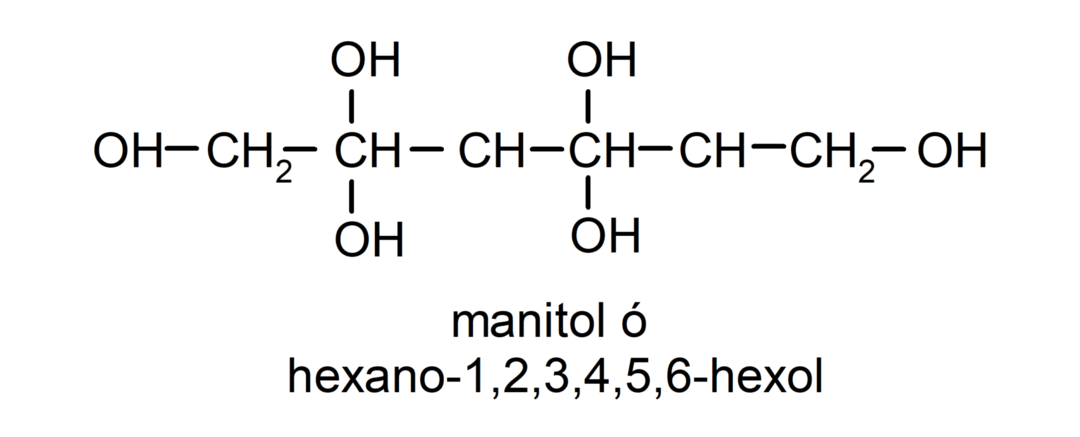
Fyzikálne vlastnosti alkoholov
Niektoré z fyzikálnych vlastností alkoholov sú:
- Bod varu. Teplota varu v alkoholoch je pomerne vysoká kvôli prítomnosti hydroxylovej skupiny, ktorá umožňuje tvorbu vodíkových väzieb. Okrem toho, čím viac hydroxylových funkčných skupín je prítomných v uhlíkovom reťazci, tým vyššia je Bod varu alkoholov.
- Polarita. Alkoholy sú celkom polárne zlúčeniny.
- Rozpustnosť. Alkoholy s nízkou molekulovou hmotnosťou sú rozpustné vo vode. Na druhej strane, čím väčší je uhlíkový reťazec alkoholov, tým nižšia je ich rozpustnosť vo vode. Okrem toho, čím viac hydroxylových skupín majú alkoholy, tým je ich rozpustnosť vo vode väčšia.
- Stav agregácie. Väčšina alkoholov je pri izbovej teplote (25ºC) tekutá a má charakteristický zápach.
Chemické vlastnosti alkoholov
Niektoré z chemických vlastností alkoholov sú:
- Alkoholy sa správajú ako kyseliny a zásady.. Ich správanie ako kyselín je možné pozorovať pri reakciách s aktívnymi kovmi pri uvoľňovaní plynného vodíka a tvorbe alkoxidov.

Ich správanie ako báz je možné pozorovať pri reakciách, ako je reakcia metanolu s bromovodíkom za vzniku metyloxóniumbromidu.
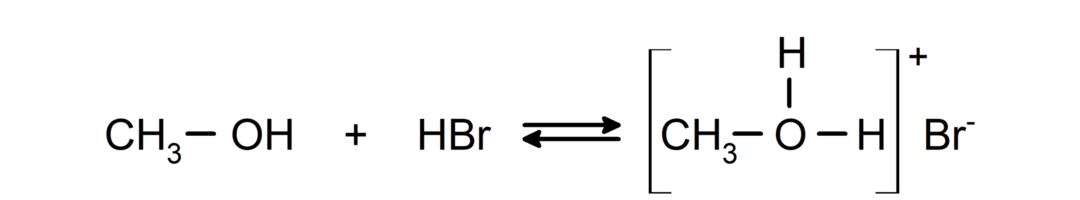
- Alkoholy podliehajú halogenačným reakciám. Reagujú s halogenovodíkmi za vzniku alkylhalogenidov.
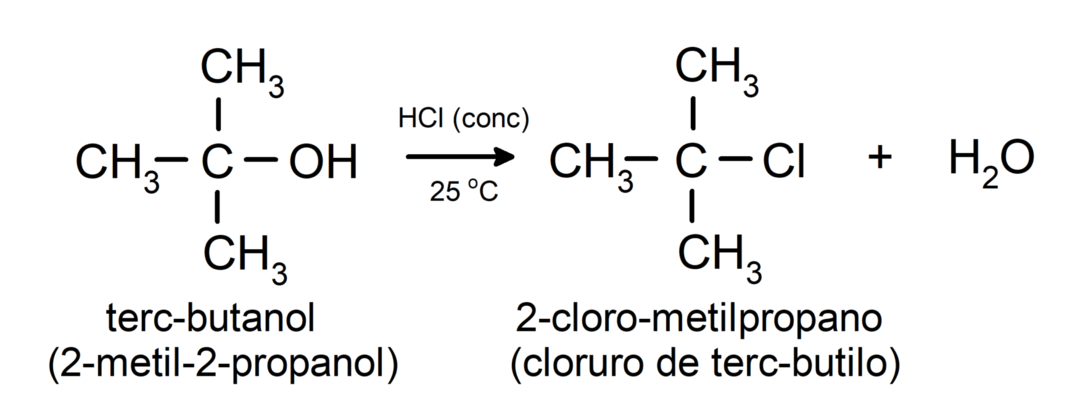
-
Alkoholy podliehajú oxidačným reakciám keď reagujú s určitými oxidačnými zlúčeninami. Produkty oxidačných reakcií závisia od typu reagujúceho alkoholu, teda či ide o primárny, sekundárny alebo terciárny alkohol.
Oxidácia primárneho alkoholu za vzniku aldehydu alebo karboxylovej kyseliny.
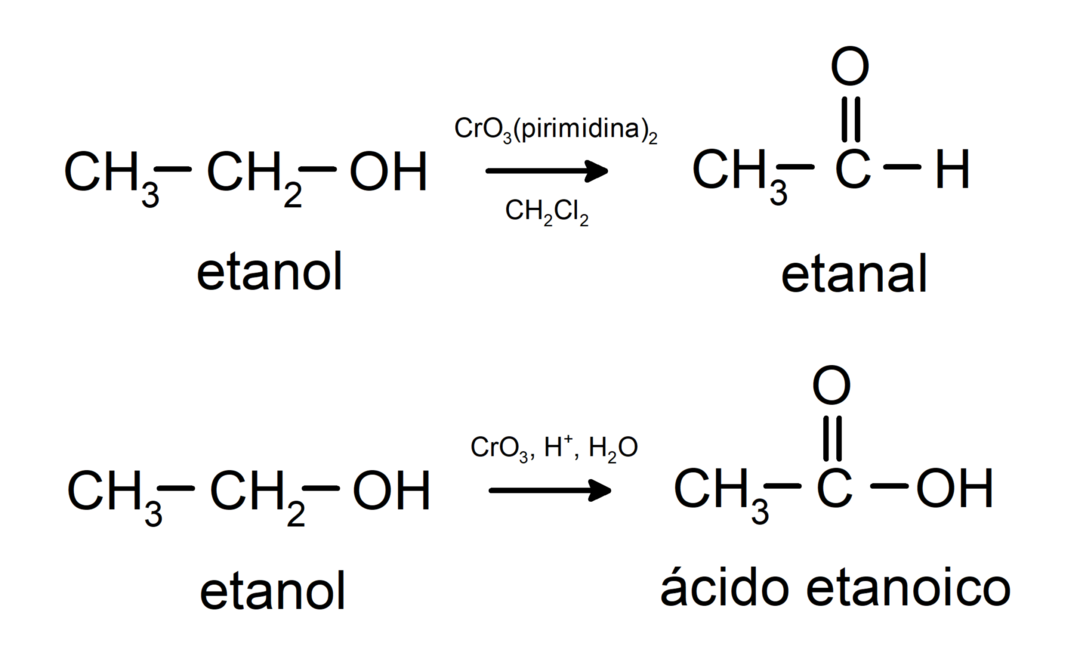
Oxidácia sekundárneho alkoholu za vzniku ketónu.
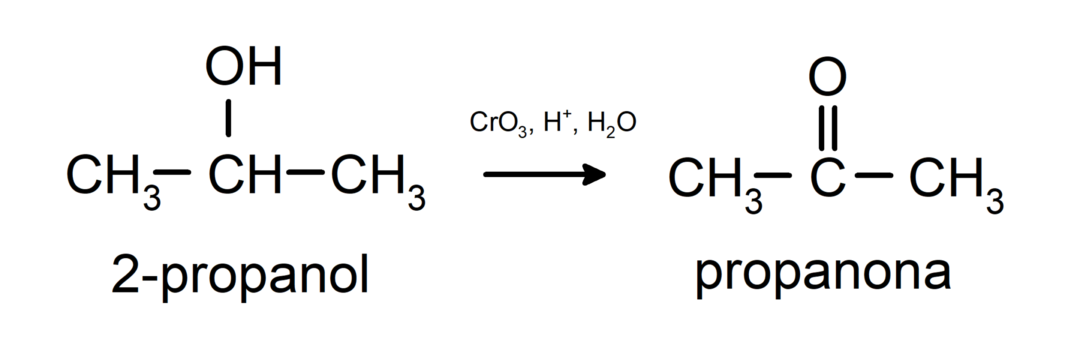
Terciárne alkoholy neoxidujú bežnými oxidantmi. Pomocou veľmi silných oxidačných činidiel sa môžu premeniť na alkény, ktoré sa potom môžu oxidovať.
Alkoholy, ktoré majú dve hydroxylové skupiny umiestnené na susedných uhlíkoch, sa oxidujú octanom olovnatým za vzniku dvoch ketónov.
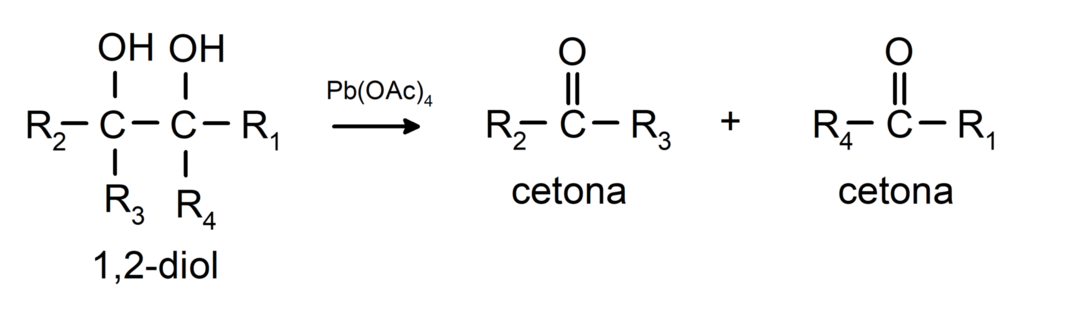
- Alkoholy podliehajú dehydrogenačným reakciám. Tieto reakcie prebiehajú iba s primárnymi a sekundárnymi alkoholmi, ktoré pri vystavení vysokým teplotám v prítomnosti katalyzátorov uvoľňujú vodíky.
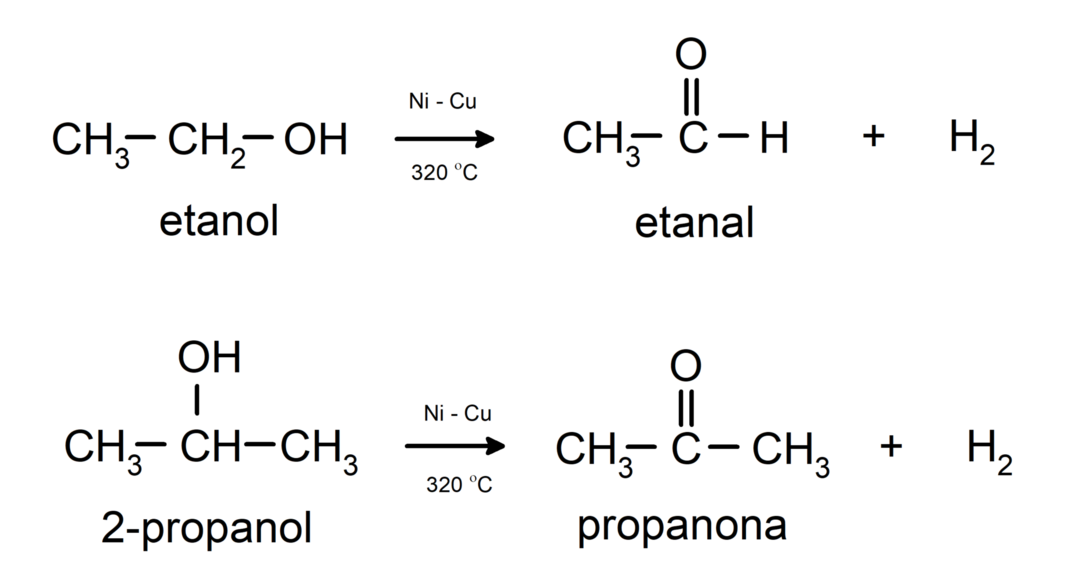
- Alkoholy podliehajú dehydratačným reakciám. Alkoholy sa dehydratujú za vzniku zodpovedajúcich alkénov. Táto reakcia prebieha v prítomnosti kyslých a stredných teplôt.
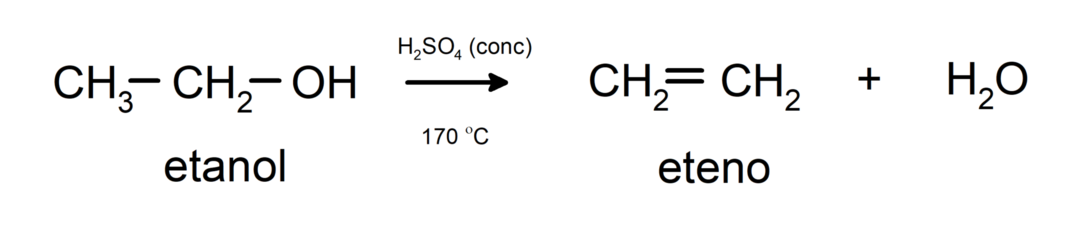
Názvoslovie alkoholu
Podľa nomenklatúry stanovenej IUPAC (Medzinárodná únia čistej a aplikovanej chémie) sú alkoholy pomenované podľa nasledujúcich pravidiel:
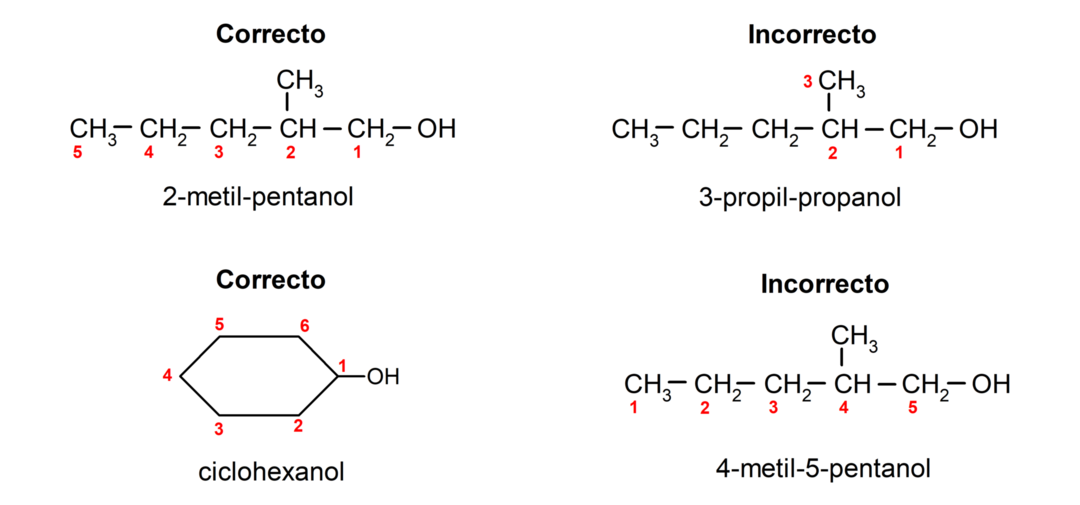
- Poloha hydroxylovej skupiny sa volí s ohľadom na to, že zaberá najnižšie možné číslo v uhlíkovom reťazci. Ak je štruktúra alkoholu cyklická, berie sa do úvahy poloha 1 na uhlíku, ku ktorému je pripojená hydroxylová skupina, a na jej pomenovanie sa používa predpona cyklo-.
- Názov alkoholu sa píše pomocou predpôn, ktoré označujú počet atómov v uhlíkovom reťazci, a navyše je umiestnená prípona -ol.
- Ak má štruktúra alkoholu vetvy, vyberie sa ako hlavný uhlíkový reťazec najdlhší reťazec, ktorý obsahuje aj hydroxylovú skupinu.
Podľa tradičnej nomenklatúry sa alkoholy pomenúvajú napísaním slova „alkohol“ a následným napísaním názvu alkoholu. alkán zodpovedajúci uhlíkovému reťazcu, ale namiesto použitia -ánového konca alkánu, koncovka -ylický.
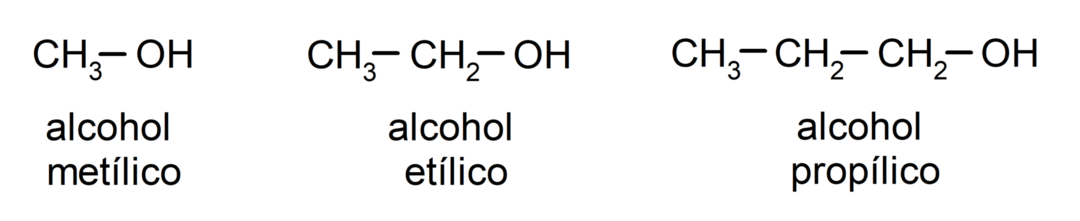
Príklady alkoholov
- metanol
- etanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-etylhexán-2-ol
- glycerol
- fenol
- 2-metyl-2-butanol
- 1,2-etándiol
- 1,5-heptadién-3-ol
- 3-metyl-2-butanol
- benzylmetanol
- 3-pentanol
- 2-metylfenol
- 1,2-dihydroxyfenol
- cykloheaxnol
- 1-fenyletanol


Užívanie alkoholov
Najbežnejšie spôsoby použitia alkoholu sú:
- Používajú sa ako dezinfekčné prostriedky a antiseptiká, pretože zastavujú rast niektorých mikroorganizmy alebo ich zničiť. Na tento účel sa najčastejšie používa etanol a izopropylalkohol.
- Používajú sa pri syntéze rôznych chemické zlúčeniny. Metanol sa napríklad používa na získanie metánu (formaldehydu).
- Používajú sa na výrobu nemrznúcej zmesi. Metanol je jedným z najpoužívanejších na tento účel.
- Používajú sa ako rozpúšťadlá vo farmaceutickom priemysle. Etanol je jedným z najpoužívanejších v tomto zmysle.
- Používajú sa ako rozpúšťadlá pre laky, farbivá a atramenty. Na tento účel sa široko používa metanol.
- Používajú sa ako palivo a existuje dôležitá tendencia čiastočne nahradiť ich fosílne palivá používaním bioetanolového paliva.
- Používajú sa na výrobu živíc. V tomto zmysle sa používa fenol.
Nebezpečenstvo konzumácie alkoholu
Hoci je dnes konzumácia alkoholu spoločensky akceptovaná, zneužívanie tejto látky vytvára závislosť a závislosť.
Etanol je alkohol prítomný v alkoholických nápojoch, ktorý pri nadmernej konzumácii ovplyvňuje kognitívnych schopností a môže spôsobiť kardiovaskulárne ochorenia, cirhózu pečene a rakovina.
Ďalej pri dosiahnutí stupňa intoxikácie alkoholom, teda stavu opitosti, ak dávka alkohol je príliš vysoký, môže nastať alkoholická kóma, ktorá môže viesť k paralýze dýchania a dokonca k smrti. smrť.
Referencie
- T. TO. Geissman. (1974) „Principles of Organic Chemistry“ Druhé vydanie. Redakcia Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. a Valdez-Montero, C. (2017). Konzumácia alkoholu ako problém verejného zdravia. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. a Boyd, R. N. (1998). Organická chémia. Pearsonovo vzdelanie.
- Weininger, S. J. a Stermitz, F. R. (1988). Organická chémia. obrátil som sa.
Nasledujte s:
- Etylalkohol
- Palivá
- organická chémia



