30 Príklady binárneho predaja
Príklady / / November 09, 2023
The binárne soli (neutrálne soli) vznikajú spojením kovu a nekovu. sú chemické zlúčeniny tvorené iba dvoma chemické prvky. Napríklad: chlorid sodný (NaCl) a bromid draselný (KBr).
- Pozri tiež: Kovy a nekovy
Príklady binárnych solí
- Chlorid sodný (NaCl)
- Chlorid železitý (FeCl2)
- Chlorid železitý (FeCl3)
- Sulfid kobaltnatý (CoS)
- Sulfid kobaltnatý (Co2Áno3)
- Sulfid olovnatý (PbS)
- Sulfid olovnatý (PbS2)
- Chlorid vápenatý (CaCl2)
- Fluorid sodný (NaF)
- Chlorid lítny (LiCl)
- Chlorid strontnatý (SrCl2)
- Chlorid bárnatý (BaCl2)
- Chlorid hlinitý (AlCl3)
- Sulfid horečnatý (MgS04)
- Chlorid rubídium (RbCl)
- Bromid vápenatý (CaBr2)
- Sulfid draselný (K2S)
- bromid horečnatý (MgBr2)
- Sulfid zinočnatý (Zn2S)
- bromid lítny (LiBr)
- Chlorid nikelnatý (NiCl2)
- Chlorid uránový (UCl3)
- bromid strieborný (AgBr)
- Jodid strieborný (AgI)
- Bromid draselný (KBr)
Nomenklatúra binárnych solí
Podľa Tradičného názvoslovia sa binárne soli pomenúvajú napísaním názvu nekovového prvku s koncovkou -ide. Na druhej strane je názov kovového prvku napísaný podľa jeho oxidačného stavu:
- Pre najnižší oxidačný stav sa píše s koncovkou -oso. Napríklad: chlorid železnatý (FeCl2), kde železo má oxidačný stav 2+.
- Pre najvyšší oxidačný stav sa píše s koncovkou -ico. Napríklad: chlorid železitý (FeCl3), kde železo má oxidačný stav 3+.
Podľa systematickej nomenklatúry sa binárne soli pomenúvajú tak, že sa názov nekovového prvku napíše s predponou, ktorá udáva množstvo atómov tohto prvku v zlúčenine. Okrem toho je v názve nekovového prvku umiestnená koncovka -uro. Potom sa umiestni názov kovového prvku. Napríklad: chlorid horečnatý (MgCl2) a chlorid železitý (FeCl3).
Podľa Stockovej nomenklatúry sa binárne soli pomenúvajú napísaním názvu nekovového prvku s koncovkou -ide. Potom sa umiestni názov kovového prvku, za ktorým nasleduje jeho oxidačný stav napísaný rímskymi číslicami a v zátvorkách. Napríklad: chlorid železitý (FeCl2) a sulfid kobaltnatý (Co2Áno3).
Aplikácie binárnych solí
- Používajú sa ako chladivá v potravinárskom a farmaceutickom priemysle. Napríklad: chlorid vápenatý (CaCl2).
- Používajú sa na ošetrenie kovových povrchov proti korózii. Napríklad: fluorid sodný (NaF).
- Používajú sa na reguláciu vlhkosti v papierenskom a stavebnom priemysle. Napríklad: chlorid vápenatý (CaCl2).
- Používajú sa v sklárskom priemysle na odstránenie nečistôt. Napríklad: chlorid kremičitý (SiCl4).
- Používajú sa ako prísady do varenia. Napríklad: chlorid sodný (NaCl).
Fyzikálne vlastnosti binárnych solí
- Majú vysoké teploty topenia, pretože sú zložené z iónové väzby.
- Pri rozpustení alebo roztavení vedú elektrický prúd.
- Najbežnejšie soli majú nízku tvrdosť.
- Nie sú stlačiteľné.
- Väčšina sa môže rozpustiť vo vode.
Ako sa získavajú binárne soli?
Binárne soli možno získať niektorými z nasledujúcich chemických reakcií:
Reakcia medzi kovom a nekovom. Napríklad: reakcia medzi sodíkom (Na) a dichloridom (Cl2) produkuje chlorid sodný (NaCl).
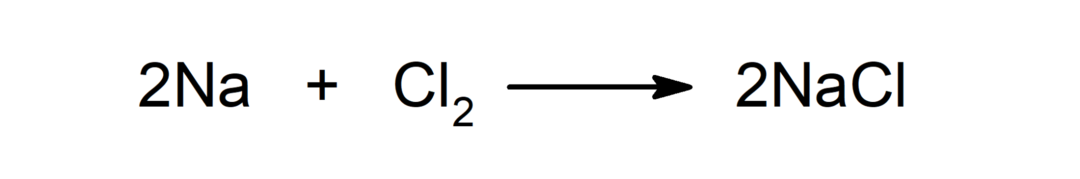
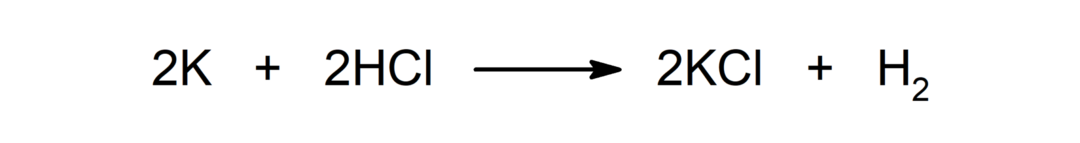
Reakcia medzi kovom a kyselinou. Napríklad: Reakciou medzi draslíkom (K) a kyselinou chlorovodíkovou (HCl) vzniká chlorid draselný (KCl) a dihydrogén (H2).
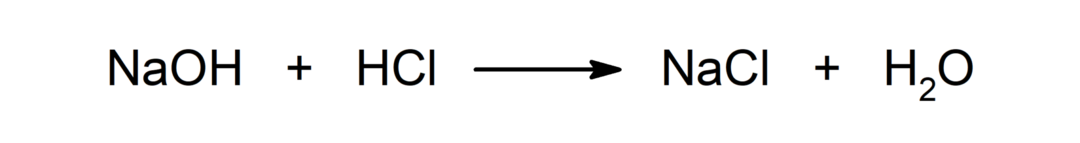
Reakcia medzi kyselinou a zásadou. Napríklad: Reakciou medzi kyselinou chlorovodíkovou (HCl) a hydroxidom sodným (NaOH) vzniká chlorid sodný (NaCl) a voda (H2BUĎ).
Nasledujte s:
- oxysoli
- neutrálne soli
- kyslé soli
Referencie
- Cerón Villalba, A., Novoa Ramírez, C. S. a Alpizar Juárez, E. (2020). Nomenklatúrne video 1: binárne soli a chemická reakcia.
- Acurio Arias, M. V. a Delgado Méndez, M. A. (2022). Herná vzdelávacia príručka pre „binárne zlúčeniny“ v stredoškolskej chémii na vzdelávacej jednotke „Herlinda Toral“ (Bakalárska práca, Národná univerzita pedagogická).
- Cabrera, M. J. H. (2005). Štúdium z prvých princípov elektrónových a štruktúrnych vlastností binárnych a ternárnych zlúčenín (Doktorandská dizertačná práca, Univerzita La Laguna).



