Príklad chemických prvkov
Chémia / / July 04, 2021
Chemický prvok je to čistá látka zložená z atómov rovnakého typu, zase tvoril množstvom protónov a neutrónov v jadrea množstvo elektróny na ich orbitáloch. Niektoré sa vyskytujú prirodzene, iné tvorením molekúl zlúčeniny a iné sa vytvorili laboratórnymi postupmi. Všetky chemické prvky tvoria hmotu celého vesmíru a udržiavajú existenciu a fungovanie ľudského tela.
Každý prvok má vlastnosti a správanie, ktoré ho odlišujú a robia jedinečným, ale zároveň predstavuje podobnosti so skupinou prvkov v prejave, ktorý majú v vesmír. Z tohto dôvodu existuje Periodická tabuľka chemických prvkov, ktorá sa venuje týmto podobnostiam, aby koherentne zoskupila prvky a uľahčila štúdium ich vlastností.
Atómové číslo prvku
Atóm nesie v jadre množstvo protónov sprevádzaných rovnakým počtom neutrónov. K tomuto číslu nazýva sa to atómové číslo, zastúpená ako Z na akademické účely a v literatúre. Pre každý prvok bude toto číslo jedinečné. Neexistujú dva prvky s rovnakým atómovým číslom. Periodická tabuľka sa zameriava aj na toto kritérium ich objednávania.
Symbol prvku
V časoch alchýmie, ktoré trvajú približne od roku 400 do 1 000 po Kr. C., alchymisti zaznamenali svoje experimenty priraďujúce symboly k prvkom. Boli to jednoduché symboly vyrobené z geometrických útvarov, ktoré predstavovali jednotlivý prvok a študované transformácie.
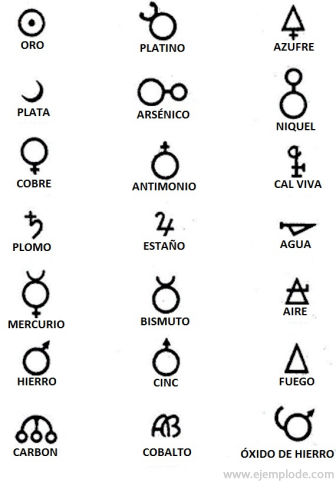
Niekoľko príkladov alchymistických symbolov s názvom prvku alebo zlúčeniny, ktorú reprezentovali.
V ére modernej chémie sú prvky stále zastúpené symbolmi, v tomto prípade písmenami, ktoré odkazujú na ich mená v latinčine alebo angličtine.
Napríklad:
Symbol pre sodík je Na, podľa jeho latinského názvu Natrium
Symbol zlata je Au, podľa jeho latinského názvu Aurum
Symbol pre striebro je Ag, podľa jeho latinského názvu Argentum
Symbol pre meď je Cu, podľa jeho latinského názvu Cuprum
Symbol antimónu je Sb, podľa jeho latinského názvu Stibium
Symbol železa je Viera, podľa jeho latinského názvu Ferrum
Symbol ortuti je Hg, podľa jeho latinského názvu Hydrargyrum, čo znamená „tekuté striebro“
Symbol pre draslík je K, podľa jeho latinského názvu Kalium
Skupiny chemických prvkov:
Periodická tabuľka chemických prvkov ich klasifikuje podľa skupín: skupiny A a skupiny B. Skupiny A sú osem, ktoré obsahujú prvky Alkalické, Alkalicko-zemitý, Terreos, tri rodiny prvkov, ktorých hlava definuje meno rodiny: Uhlíková rodina, Dusíkatá rodina, Sulphur Family, Halogény a Ušľachtilé plyny. Skupiny B sú tvorené všetkými Prechodné kovy a Zriedkavé zeminy, ktoré sú tiež dvoma veľkými rodinami: Lanthanidy Y. Aktinidy.
Skupina IA: Alkalické prvky:
Sériu alkalických prvkov tvoria vodík (H), lítium (Li), sodík (Na), draslík (K), rubídium (Rb), cézium (Cs) a francium (Fr). Všetky majú elektronickú konfiguráciu, takže v poslednej škrupine majú elektrón. Ich názov je spôsobený tým, že pri kontakte s vodou reagujú za vzniku zásad alebo hydroxidov. Je to všeobecné správanie medzi týmito prvkami. Čím väčší je atóm prvku, tým je reaktívnejší, pretože sila, s ktorou jadro zadržuje elektrón z poslednej škrupiny, má čoraz menší dosah. Sú schopné vytvárať iónové väzby s halogénmi. Napríklad: Iónová väzba, ktorá má hojnú prítomnosť, je väzba sodíka a chlóru, ktorá vytvára chlorid sodný. NaCl.
Skupina IIA: Prvky alkalických zemín:
Ide o tieto prvky: berýlium (Be), horčík (Mg), vápnik (Ca), stroncium (Sr), bárium (Ba) a rádium (Ra). Nie sú slobodnej povahy; na druhej strane jeho uhličitany a kremičitany existujú v relatívnom množstve. Sú argentínske biele a kryštalické. Ak sú vystavené vzduchu, ľahko sa kombinujú s kyslíkom. Čiastočne je to spôsobené tým, že vo svojej poslednej škrupine majú dva elektróny, čo zodpovedá kapacite prijímania kyslíka. Bárium je najaktívnejším prvkom skupiny a spolu s vápnikom patria k najpriemyselnejším aplikáciám v skupine.
Skupina IIIA: Prvky Zeme:
Skupina IIIA obsahuje prvky bór (B), hliník (Al), gálium (Ga), indium (in) a tálium (Tl). Bór je nekovový prvok, hliník je amfotérny (amfiprotický), to znamená, že je schopný pôsobiť ako kyselina a ako zásada; a ďalšie tri sú kovové prvky. Vo svojom poslednom obale majú tri elektróny, ktoré generujú valenciu +3, hoci niekedy Gálium v niektorých svojich zlúčeninách pôsobí s valenciou +1 a +2. Bór je jediný prvok v tejto sérii, ktorý vytvára hydridy. Bór a hliník tvoria karbidy.
Skupina IVA: Rodina uhlíkov:
Reprezentatívne prvky skupiny IVA sú uhlík (C), kremík (Si), germánium (Ge), cín (Sn) a olovo (Pb). Prvé dva sú vo svojej podstate zásadne nekovové, ale germánium, cín a olovo sú kovové a tým viac, čím vyššie je ich atómové číslo. S výnimkou kremíka má každý prvok valencie +4 a +2.
Uhlík a kremík tvoria zlúčeniny, v ktorých sú atómy prvkov spojené pármi zdieľaných elektrónov. Uhlík je podstatou organických zlúčenín tým, že sa spája s atómami vodíka, kyslíka, dusíka, síry a niekedy aj kremíka.
Na výrobu elektronických súčiastok sa používa kremík a germánium, pretože sa správajú ako polovodiče.
Skupina VA: Rodina dusíka:
Skupina VA obsahuje prvky dusík (N), fosfor (P), arzén (As), antimón (Sb) a bizmut (Bi). Dusík a fosfor sú nekovové, arzén a antimón sú metaloidy a bizmut je kov. Tieto prvky sa vyznačujú tvorbou hydridov, z ktorých najmenej toxický je amoniak NH3. Dusík tvorí kyselinu dusičnú HNO3, zapojený spolu s kyselinou chlorovodíkovou v Agua Regia, zmesou schopnou rozpúšťať drahé kovy ako zlato a striebro.
Dusík je tiež zapojený do dvoch veľkých skupín organických zlúčenín nazývaných amíny a amidy, ktoré možno považovať za deriváty amoniaku NH3, substitúciou vodíka za uhľovodíkový reťazec.
Skupina VIA: Rodina kyslíka:
Skladá sa z prvkov kyslík (O), síra (S), selén (Se), telúr (Te) a polónium (Po). Kyslík je najaktívnejší a má schopnosť ľahko vytvárať kovalentné väzby. Pri kontakte s kovmi v prostredí s vysokou vlhkosťou vytvára oxidy. Tvorí rezonančnú molekulu zvanú Ozón, ktorá chráni planétu pred UV žiarením.
Skupina VIIA: Halogény:
Jeho názov znamená „Tvorcovia predaja“. Skupinu tvoria prvky fluór (F), chlór (Cl), bróm (Br), jód (I) a astát (At). V poslednej škrupine majú sedem elektrónov, čo im umožňuje byť receptormi pre jeden elektrón. Táto vlastnosť ich robí prepojením s prvkami skupiny IA a tvorením binárnych solí. Fluor je charakteristický tým, že má najväčšiu elektronegativitu z celej periodickej tabuľky s hodnotou 4,0, jej náprotivkom je cézium, s elektronegativitou 0,7. Táto vlastnosť mu umožňuje mať silu prilákať ďalšie atómy a dať prednosť vytvoreniu väzby s oni.
Skupina VIIIA: Ušľachtilé plyny:
Nazýva sa aj skupina inertných plynov a je zložená z prvkov hélium (he), neón (ne), argón (ar), kryptón (kr), xenón (xe) a radón (Ra). Sú to prvky, ktoré majú celú svoju úplnú elektronickú konfiguráciu, takže nie sú schopné reagovať za bežných podmienok. Používajú sa hlavne na svetelné obchodné značky, ktoré emitujú viditeľné svetlo, keď na ne dopadne elektrický prúd.
Skupina B: Prechodné kovy:
V desiatich skupinách po troch prvkoch sú prechodné kovy zoskupené. Patria sem najlepšie elektrické vodiče: striebro (Ag), meď (Cu), zlato (Au); najlepšie konštrukčné prvky pre mestskú výstavbu a inžinierstvo; Železo (Fe), titán (Ti), hliník (Al), zirkónium (Zr), volfrám (W); najlepšie komponenty katalyzátora: nikel (Ni), vanád (V), platina (Pt); a hlavné zložky poťahu: kadmium (Cd), chróm (Cr), zinok (Zn). Spravidla spracovávajú valencie medzi +1 a +3, ale prvky ako Chromium spracovávajú valencie +2, +3, +6.
Zriedkavé zeminy: lantanoidy a aktinidy:
Pre svoj nedostatok na planéte sa im hovorí vzácne zeminy. Skladajú sa z dvoch skupín: lanthanoidy a aktinidy. Nachádzajú sa na dvoch samostatných riadkoch periodickej tabuľky. Všeobecne pracujú s valenciou +3 a majú tendenciu vytvárať hydroxidy. Najdôležitejším prvkom medzi nimi je cér, ktorý sa používa pri príprave pyroforických zliatin (Alloy Mischmetal, na kamene do zapaľovačov), v plynových hadiciach na osvetlenie a pri výrobe špeciálnych okuliarov absorbujúcich ultrafialové lúče a tepelné žiarenie.
Najvýkonnejšie rádioaktívne prvky, ako sú urán (U) a plutónium (Pu), sú súčasťou týchto skupín. že vzhľadom na ich nestabilitu uvoľňujú energiu a rozpadajú sa, strácajú alfa častice (jadrá z Hélium). Neskôr sa podľa rádioaktívnych sérií stanú menej nestabilnými prvkami.
