Vlastnosti lantanoidu
Chémia / / July 04, 2021
Lantanidy sú chemické prvky, ktoré sa pohybujú od lantánu po lutecium. Zdieľajú spoločné znaky, pre ktoré sú klasifikovaní v osobitnej kategórii v dolnej časti periodickej tabuľky.
Hlavné charakteristiky lantanoidov:
- Nachádzajú sa v období 6 periodickej tabuľky.
- Zahŕňajú 15 prvkov, od 57 do 71.
- Zdieľajú štruktúru lantánu, ku ktorému sa pridáva energetická hladina f, ktorá je chemicky menej reaktívna.
- Volali sa vzácne zeminy, pretože v prírodnom stave sa vždy spojili a vytvorili oxidy.
- Niektoré sú pomerne hojné.
- Aj keď majú variabilné valencie, väčšina má valencie +3.
- So zvyšovaním jeho atómového čísla sa zmenšuje aj jeho polomer.
- Všetky majú lesklý kovový vzhľad.
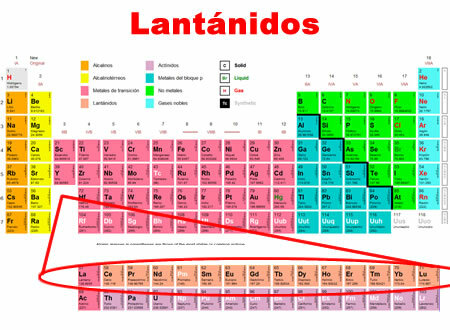
Jednotlivé charakteristiky lantanoidov:
Lanthan (La).
- Atómové číslo 57
- Atómová hmotnosť: 139
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 920 ° C
- Teplota varu: 3457 ° C
Objavený bol v roku 1839. V priemysle sa používa v zliatinách s inými lantanoidmi na výrobu ľahších kameňov; v optike sa používa pre optické okuliare. Používa sa tiež na vodíkové špongie, ktoré obsahujú plyn. V medicíne sa používa vo forme uhličitanu lantanitého na liečbu zlyhania obličiek, pretože má afinitu k zmiešaniu s fosfátmi, čo znižuje hyperfosfémiu.
Cer (Ce)
- Atómové číslo 58
- Atómová hmotnosť: 140
- Stav: mäkký pevný
- Vzhľad: kovový, striebornošedý, podobný železu
- Valencia: +3, +4
- Teplota topenia: 798 ° C
- Teplota varu: 3426 ° C
Objavený bol v roku 1803. Je to najhojnejší lantanoid. Používa sa na výrobu katalyzátorov, hlavne pre automobily (katalyzátory) a na krakovanie oleja. Vo forme oxidu sa používa na leštenie okuliarov a šošoviek. Aj keď nemá známe biologické funkcie, v medicíne sa používa na masti na popáleniny.
Praseodymium (Pr)
- Atómové číslo 59
- Atómová hmotnosť: 144
- Stav: mäkký pevný
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 931 ° C
- Teplota varu: 3520 ° C
Bol objavený v roku 1841 a izolovaný v roku 1885. V priemysle sa používa v zliatinách s horčíkom na výrobu leteckých motorov; Používa sa na získanie žltého sfarbenia skla a emailov. Zliatiny niklu majú magnetické vlastnosti. Reaguje s halogénmi za vzniku fluoridov, chloridov, bromidov a jodidov.
Neodým (Nd)
- Atómové číslo 60
- Atómová hmotnosť: 139
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1024 ° C
- Teplota varu: 3100 ° C
Objavený bol v roku 1885, keď bolo izolované praseodým; neodým bol izolovaný až do roku 1925. Je to jeden z najreaktívnejších lantanoidov. V priemysle sa používa na farbenie skla a smaltov. Pre svoju schopnosť absorbovať svetlo sa v astronómii používa na vytváranie kryštálov, pomocou ktorých sa kalibrujú infračervené spektrometre a filtre. Jedným z jeho hlavných použití je výroba magnetov s vysokou magnetickou intenzitou. Tieto magnety sa používajú pre presné prístroje, ako sú magnety používané na pevných diskoch počítačov, ako aj pre niektoré tenké reproduktory.
Prometium (Pm)
- Atómové číslo 61
- Atómová hmotnosť: 145
- Pevné skupenstvo
- Vzhľad:?
- Valencia: +3
- Teplota topenia: 1100 ° C
- Teplota varu: 3000 ° C
Jeho existencia sa predpokladala v roku 1902, ale dokázať sa dal až v roku 1944. Tento lantanoid sa v prírode nenachádza, je zdrojom jeho získavania a štúdia štiepenia uránu. Pri štiepení uránu v jadrovom reaktore je jedným z atómov produkovaných touto atómovou separáciou promécium. Má rádioaktívne vlastnosti, ktoré mu dodávajú fosforescenciu, a používa sa pre kalibrátory a jadrové batérie používané v kozmických lodiach.
Samárium (Sm)
- Atómové číslo 62
- Atómová hmotnosť: 150
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1072 ° C
- Teplota varu: 1803 ° C
Bol objavený v roku 1853 a izolovaný v roku 1879. Má niekoľko izotopov a najmenej dva z nich sú rádioaktívne. V priemysle sa v optike používa na výrobu kryštálov, ktoré absorbujú infračervené svetlo. Používa sa tiež ako katalyzátor na získanie alkoholu a ako prvok v niektorých žiarivkách a televízoroch. Pokiaľ ide o zdravie, pri vdýchnutí (napríklad oxidom používaným na leštenie kryštálov) môže spôsobiť pľúcne embólie alebo poškodiť pečeň. Rádioaktívne izotopy sa používajú pri rádioterapii nevyliečiteľne chorých pacientov.
Europium (Eu)
- Atómové číslo 63
- Atómová hmotnosť: 152
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +2, +3
- Teplota topenia: 826 ° C
- Teplota varu: 1527 ° C
Bol objavený v roku 1890. Je najreaktívnejší z lantanoidov. Používa sa v žiarivkách a televízoroch, avšak na vyvolanie pľúcnej embólie, ak je vdychovaný alebo poškodený, ak sa nahromadí v ľudskom tele, nemá takmer žiadne priemyselné využitie. Pri atómovom výskume sa používa, pretože absorbuje neutróny.
Gadolínium (Gd)
- Atómové číslo 64
- Atómová hmotnosť: 157
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1312 ° C
- Teplota varu: 3250 ° C
Gadolínium má málo použití, hlavným je magnetické priemyselné chladenie, pretože zvyšuje svoje magnetické vlastnosti pri nízkych teplotách; ale keďže tento typ chladičov vyžaduje použitie arzénu, nepoužívajú sa v domácich chladiacich zariadeniach. V medicíne sa používa ako kontrastná látka pre magneticko-jadrovú rezonanciu.
Terbium (Tb)
- Atómové číslo 65
- Atómová hmotnosť: 159
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +4
- Teplota topenia: 1356 ° C
- Teplota varu: 3230 ° C
Bol objavený v roku 1843 a izolovaný v roku 1905. Je to veľmi dôležité v elektronickom priemysle, pretože je to jeden z prvkov používaných na výrobu polovodičov. Iné využitie je na výrobu žiariviek a obrazoviek. Používa sa tiež ako katalyzátor v palivových článkoch. Aj keď nemá biologické funkcie, jeho vdýchnutie alebo vstup do ľudského tela má toxické účinky, hlavne na pečeň.
Dysprosium (Dy)
- Atómové číslo 66
- Atómová hmotnosť: 162,5
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +2, +3
- Teplota topenia: 1407 ° C
- Teplota varu: 2567 ° C
Bol objavený v roku 1843 a izolovaný v roku 1905. Je to veľmi dôležité v elektronickom priemysle, pretože je to jeden z prvkov používaných na výrobu polovodičov. Iné využitie je na výrobu žiariviek a obrazoviek. Používa sa tiež ako katalyzátor v palivových článkoch. Aj keď nemá biologické funkcie, jeho vdýchnutie alebo vstup do ľudského tela má toxické účinky, hlavne na pečeň.
Holmium (Ho)
- Atómové číslo 67
- Atómová hmotnosť: 166
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1474 ° C
- Teplota varu: 2700 ° C
Bol objavený v roku 1878 a jeho názov je odvodený od mesta jeho objavu, Štokholmu, latinsky Holmia. Nemá takmer žiadne praktické využitie; v niektorých priemyselných odvetviach sa však používa ako katalyzátor chemických reakcií, ako aj pre niektoré elektronické súčiastky. Používa sa tiež na zmenu frekvencie a intenzity laserového lúča.
Erbium (Er)
- Atómové číslo 68
- Atómová hmotnosť: 167
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1795 ° C
- Teplota varu: 2863 ° C
Bol objavený v roku 1843. Používa sa v jadrovom priemysle ako neutrónový nárazník. Vo forme oxidu je to farbivo pre kryštály, ktoré im dodáva ružový odtieň; Tieto kryštály sa používajú v optike a šperkoch. Používa sa tiež na výrobu optických vlákien.
Thulium (Tm)
- Atómové číslo 69
- Atómová hmotnosť: 167
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1545 ° C
- Teplota varu: 1947 ° C
Bol objavený v roku 1879. Napriek nízkej dostupnosti, kvôli svojim rádioaktívnym vlastnostiam, sa hlavne používa ako zdroj röntgenových lúčov v prenosných zariadeniach a pre polovodičové lasery.
Ytterbium (Yb)
- Atómové číslo 70
- Atómová hmotnosť: 173
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 824 ° C
- Teplota varu: 1194 ° C
Bol objavený v roku 1878 a izolovaný v roku 1907. Rádioaktívne izotopy sa používajú pre prenosné röntgenové zariadenia, ktoré fungujú bez elektriny. Používa sa tiež na zlepšenie oceľových zliatin a na zvýšenie ich odolnosti, čo je vlastnosť používaná v zubnom lekárstve, v dôsledku zlepšenia mechanických vlastností ocele. Musí sa s ním narábať opatrne, pretože môže spôsobiť podráždenie a popáleniny. Okrem toho môže pri reakcii so vzduchom spôsobiť výbuch alebo požiar.
Lutetium (Lu)
- Atómové číslo 71
- Atómová hmotnosť: 175
- Pevné skupenstvo
- Vzhľad: kovový, strieborno biely
- Valencia: +3
- Teplota topenia: 1652 ° C
- Teplota varu: 3402 ° C
Objavený bol v roku 1907. Je to najmenej hojný chemický prvok v zemskej kôre. Napriek svojej nízkej dostupnosti sa používa na rafináciu oleja a ako katalyzátor reakcií organickej chémie. Niektoré rádioaktívne izotopy boli tiež testované na ožarovanie.


