Čo je to elektrolýza
Chémia / / July 04, 2021
V chémii, Elektrolýza je jav, pri ktorom elektrický prúd preteká vodným roztokom iónovej zlúčeniny, a začína nasmerujte ióny (nabité častice) zlúčeniny a dve elektródy, pozitívne (Anóda, priťahuje záporne nabité anióny) a záporné (Katóda, priťahuje kladne nabité katióny). Tento jav sa riadi zákonom o elektrostatike, ktorý naznačuje, že opačné náboje sa navzájom lákajú.
Elektrolyty
V roku 1883 Michael Faraday zistili, že vodné roztoky určitých látok vedú elektrický prúd, zatiaľ čo roztoky iných látok nie.
Na vyskúšanie toho, či vodný roztok vedie elektrický prúd alebo nie, navrhol Faraday jednoduchý prístroj pozostávajúci z a 110 voltový obvod jednosmerného prúdu, lampa, Y pripojené dve kovové alebo grafitové elektródy k súčasnému zdroju.
Ak sú elektródy ponorené vo vode, je množstvo pretekajúceho prúdu také malé, že žiarovka nesvieti; to isté platí, ak sú ponorené do roztoku cukru.
Naopak, ak sú ponorené do riešenia Chlorid sodný NaCl alebo z Kyselina chlorovodíková HCl, lampa jasne svieti, čo dokazuje, že
rozpustenie je vynikajúci dirigent. Na druhej strane, s použitím kyseliny octovej CH3Koncentrovaný COOH, roztok vedie prúd zle, ale keď sa kyselina zriedi vodou H2Alebo sa zvyšuje jeho elektrická vodivosť.Počas prechodu prúdu rôznymi roztokmi sa na elektródach získavajú rôzne produkty.
V priebehu štúdia elektrolýzy vyvodil Faraday nasledujúce zákony:
1. zákon: Množstvo látky, ktorá chemicky prechádza v elektróde, je úmerné množstvu elektriny, ktorá prechádza roztokom.
2. zákon: Ak rovnaké množstvo elektriny prechádza rôznymi riešeniami, hmotnosti látok rozložené alebo uložené na rôznych elektródach sú úmerné ekvivalentnej hmotnosti uvedených elektród látok.
Uvediem príklad:
Bude sa predpokladať, že máte päť rôznych elektrolytických článkov. Prvý s Kyselina chlorovodíková HCl, druhý s Síran meďnatý CuSO4, tretí s Antimonious Chloride SbCl3, štvrtý s Chlorid cínatý SnCl2 a piaty s Chlorid cíničitý SnCl4.
Rovnaký prúd prechádza sériou elektrolytických článkov, kým sa neuvoľní 1 008 gramov vodíka (a Ekvivalentná hmotnosť vodíka) roztoku kyseliny chlorovodíkovej, hmotnosti (v gramoch) ostatných produktov uvoľnených v rovnakom čase Oni sú:
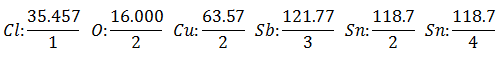
The Ekvivalentná hmotnosť má hodnotu Atómová hmotnosť prvku vydelená Valenciou prvku.
Na uvoľnenie ekvivalentnej hmotnosti ľubovoľnej položky potrebujete 96500 Coulombov. Toto množstvo elektriny sa nazýva 1 Faraday.
Faradayova jednotka
Ampér je definovaný ako rovnomerný prúd, ktorý ukladá 0,001118 gramov striebra (Ag) z roztoku dusičnanu strieborného (AgNO3) o sekundu. Pretože atómová hmotnosť striebra je 107,88 g / mol, pomer 107,88 / 0,001118 dáva počet ampérsekund alebo Coulombs potrebná elektrina uložiť chemický ekvivalent striebra. Toto množstvo je 96494 Coulombov (hodnota 96500 je pre približné výpočty pomerne približná) a nazýva sa 1 Faraday elektriny.
Elektródy
Ozval sa Faraday Anóda na pozitívnu elektródu a katóda na negatívnu elektródu. Vytvoril tiež pojmy anión a katión, ktoré sa vzťahujú na látky, ktoré sa počas elektrolýzy objavujú na anóde a na katóde.
V súčasnosti existuje iná definícia elektród:
Anóda: Elektróda, v ktorej dochádza k strate elektrónov alebo oxidácii.
Katóda: Elektróda, v ktorej je elektrónový zisk alebo redukcia.
Elektrolyty a neelektrolyty
Vedenie elektrického prúdu cez roztoky nebolo uspokojivo vysvetlené až do roku 1887, keď dal svoju teóriu najavo Svante Arrhenius. Pred ocenením a pochopením Arrheniovej teórie sme si najskôr predstavili niektoré z faktov, ktoré veda poznala, keď ju Arrhenius formuloval:
The Neelektrolytové riešenia majú vlastnosti, ktoré sa dajú vypočítať použitím Raoultovho zákona. Tlak pár a pozorované teploty varu a tuhnutia týchto roztokov sú prakticky rovnaké ako vypočítané hodnoty.
The Raoultov zákon vysvetľuje, že tlak pár každej rozpustenej látky v roztoku závisí od jeho vlastnej molárnej frakcie v ňom vynásobenej jeho tlakom pár v čistom stave.

Raoultov zákon zlyháva pri aplikácii na roztoky elektrolytov vo vode. Odchýlky tlaku pár a bodov varu a tuhnutia sú vždy väčšie ako tie, ktoré predpovedá vyššie uvedený zákon, a navyše sa zvyšujú pri zriedení.
Takéto odchýlky predstavuje hodnota i, ktorá je pomerom variácie pozorovanej v bode mrazu medzi odchýlkou vypočítanou v bode mrazu:

Hodnota i je mierou odchýlky od Raoultovho zákona, ktorá sa rovná 1, ak neexistuje odchýlka.
Elektrická vodivosť elektrolytov
Arrhenius skúmal vodivosť vodných roztokov elektrolytov, aby zistil, ako sa mení vodivosť s koncentráciou elektrolytu.
Merala sa molárna vodivosť (čo je vodivosť zodpovedajúca jednému molu rozpusteného elektrolytu; to znamená špecifická vodivosť vzťahujúca sa na jedného móla a zistilo sa, že riedením stúpala.
Arrhenius porovnal svoje výsledky s meraniami odchýlok od Raoultovho zákona a našiel blízky vzťah medzi týmito a molárnou vodivosťou. V jeho teórii je vysvetlené správanie elektrolytov:
"Molekuly elektrolytu sa rozpadajú na elektricky nabité častice nazývané ióny." Rozpustenie je neúplné a medzi molekulami a ich iónmi existuje rovnováha. Ióny vedú prúd pri svojom pohybe v roztoku “.
Odchýlky od Raoultovho zákona sú spôsobené zvýšením počtu častíc v dôsledku čiastočnej disociácie molekúl.
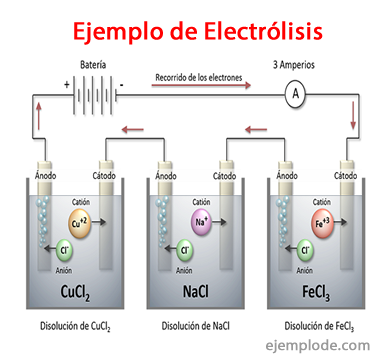
Príklady elektrolýzy
Niektoré riešenia, ktoré sa správajú ako elektrolyty, to znamená, že majú kapacitu na elektrolýzu, sú:
Chlorid sodný NaCl
Kyselina chlorovodíková HCl
Síran sodný Na2SW4
Kyselina sírová H2SW4
Hydroxid sodný NaOH
Hydroxid amónny NH4Oh
Uhličitan sodný Na2CO3
NaHCO hydrogenuhličitan sodný3
Kyselina dusičná HNO3
Dusičnan strieborný AgNO3
Síran zinočnatý ZnSO4

