Príklad aromatických zlúčenín
Chémia / / July 04, 2021
Chemici zistili, že je užitočné rozdeliť všetky organické zlúčeniny do dvoch širokých tried: zlúčeniny Alifatický a zlúčeniny Aromatické látky. Aromatické zlúčeniny sú benzén a zlúčeniny s podobným chemickým správaním. Aromatické vlastnosti sú to, čo odlišuje benzén od alifatických uhľovodíkov. Molekula benzénu je kruh konkrétneho typu. Existujú aj ďalšie zlúčeniny, tiež kruhového tvaru, ktoré sa štrukturálne líšia od benzénu, a napriek tomu sa správajú podobným spôsobom.
Ukázalo sa, že tieto ďalšie zlúčeniny pripomínajú vo svojej základnej elektrónovej štruktúre benzén, a preto sa správajú aj ako aromatické látky.
Alifatické uhľovodíky (alkány, alkény, alkíny a ich cyklické analógy) reagujú hlavne s dodatok, vo viacerých odkazoch a substitúcia voľnými radikálmi, v iných bodoch alifatického reťazca.
Na druhej strane, aromatické uhľovodíky sa zdôrazňuje, že majú sklon k heterolytická substitúcia. Tieto rovnaké substitučné reakcie sú navyše charakteristické pre aromatické kruhy, nech sa vyskytujú kdekoľvek, bez ohľadu na to, aké ďalšie funkčné skupiny môže molekula obsahovať. Tieto posledné uvedené skupiny ovplyvňujú reaktivitu aromatických kruhov a naopak.
Molekula benzénu
Benzén je známy od roku 1825 a jeho chemické a fyzikálne vlastnosti sú známejšie ako vlastnosti ktorejkoľvek inej organickej zlúčeniny. Napriek tomu bola na tento účel navrhnutá uspokojivá štruktúra až v roku 1931 a trvalo to až 15 rokov, kým sa všeobecne používal medzi chemikáliami organický. Ťažkosti spočívali v obmedzeniach vývoja, ktoré dovtedy štrukturálna teória dosiahla. Konečná štruktúra sa dosiahla predpokladom niekoľkých dôležitých skutočností:
Benzén má molekulárny vzorec C.6H6. Vďaka svojmu elementárnemu zloženiu a molekulovej hmotnosti bol benzén známy tým, že má šesť atómov uhlíka a šesť atómov vodíka. Problémom bolo poznať usporiadanie takýchto atómov.
V roku 1858 August Kekulé navrhol, že atómy uhlíka je možné spojiť za vzniku reťazcov. Neskôr, v roku 1865, ponúkol odpoveď na problém s benzénom: tieto karbonátové reťazce môžu byť niekedy uzavreté, aby vytvorili krúžky.
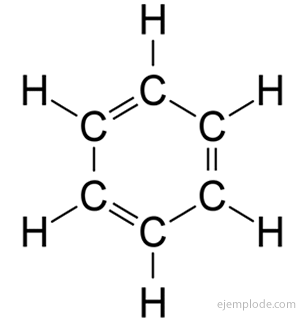
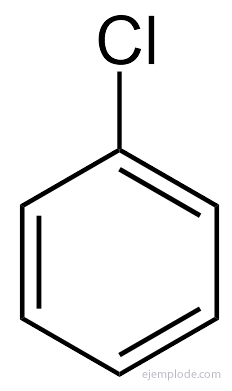
Benzén poskytuje iba monosubstituovaný produkt C.6H5Y.. Napríklad, keď je atóm vodíka nahradený brómom, získa sa iba jedna konfigurácia brómbenzénu C.6H5Br; analogicky sa tiež získa chlórbenzén C6H5Cl alebo NitroBenzene C.6H5NIE2, atď. Táto skutočnosť predstavuje vážne obmedzenie štruktúry benzénu: musí to byť všetok jeho vodík presne rovnocenné, to znamená, že musia byť všetci spojení s uhlíkmi, ktoré sú zase všetky rovnako spojený. V CH nemôžu byť žiadne vodíky3a ďalšie v CH2a ďalšie v CH. Konečná štruktúra monosubstituovanej látky by mala byť rovnaká pre substitúciu vodíka v benzéne.
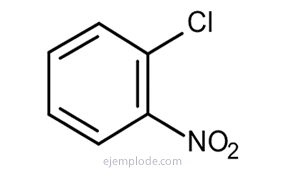
Benzén poskytuje tri izomérne disubstituované produkty, C6H4Y.2 alebo C.6H4A Z. Existujú iba tri izomérne DiBrombenzény, C.6H4Br2, tri ChlórNitroBenzény C6H4ClNO2, atď. Táto skutočnosť ďalej obmedzuje štrukturálne možnosti.
Benzén skôr ako adičnými reakciami podlieha substitučným reakciám. Benzénová štruktúra Kekulé zodpovedá tej, ktorú by sme nazvali Cyklohexatrién. Z tohto dôvodu by mal ľahko reagovať prídavkom, rovnako ako podobné zlúčeniny, cyklohexadién a cyklohexén, čo je charakteristické pre štruktúru alkénov. Ale to tak nie je; v podmienkach, keď alkény reagujú rýchlo, benzén nereaguje alebo iba veľmi pomaly. Namiesto adičných reakcií benzén ľahko podlieha množine reakcií, ktoré všetky sú zámenaako Nitrácia, Sulfonácia, Halogenácia, Friedel-Craftsova alkylácia, Acylácia od Friedel-Crafts. V každej z týchto reakcií bol atóm alebo skupina nahradená jedným z atómov vodíka benzénu.
Stabilita benzénu je spôsobená striedajúcimi sa dvojitými väzbami a tiež rezonančnou energiou v ten, v ktorom dvojité väzby menia svoju polohu medzi uhlíkmi, pričom zachovávajú rovnaké striedanie štrukturálne. Je energia na stabilizáciu rezonancie je zodpovedný za množinu volaných vlastností Aromatické vlastnosti.
Adičná reakcia zmení alkén na stabilnejšiu nasýtenú zlúčeninu. Ale v prípade benzénu ho prídavok robí menej stabilným, pretože ničí kruhový systém udržiavaný a stabilizovaný rezonanciou. Konečnou molekulou by bol cyklohexadién. Kvôli tejto skutočnosti stabilita benzénu vedie iba k substitučným reakciám.
Vlastnosti aromatických zlúčenín
Okrem látok, ktoré obsahujú benzénové kruhy, existuje ešte veľa ďalších, ktoré sa považujú za aromatické, hoci na povrchu sa len ťažko podobajú benzénu.
Z experimentálneho hľadiska sú aromatické zlúčeniny látky, ktorých molekulárne vzorce naznačujú a vysoký stupeň nenasýtenia, napriek ktorým sú odolný voči adičným reakciám tak charakteristické pre nenasýtené zlúčeniny.
Namiesto toho tieto aromatické zlúčeniny a často podstupujú elektrofilné substitučné reakcie podobné tým z benzénu. Spolu s touto odolnosťou proti pridávaniu a pravdepodobne kvôli nej existujú dôkazy o a neobvyklá stabilita, ako sú nízke teploty pri hydrogenácii a spaľovaní.
Aromatické látky sú cyklické, obvykle s kruhmi s piatimi, šiestimi a siedmimi atómami a ich fyzikálne vyšetrenie ukáže, že majú ploché alebo takmer ploché molekuly. Jeho protóny majú rovnaký typ chemického posunu v spektrách nukleárnej magnetickej rezonancie ako v benzéne a jeho derivátoch.
Z teoretického hľadiska musí byť látka, ktorá má byť aromatická, mať cyklické oblaky delokalizovaných π elektrónov nad a pod rovinou molekuly; Ďalej tieto π mraky musia obsahovať celkom (4n + 2) π elektrónov; to znamená, že premiestnenie nie je dostatočné na dosiahnutie konkrétnej stability, ktorá charakterizuje aromatickú zlúčeninu.
Nomenklatúra benzénových derivátov (aromatické zlúčeniny)
V prípade mnohých z týchto derivátov, najmä v prípade monosubstituovaných, stačí uviesť substitučná skupina pre slovo benzén, ako je napríklad chlórbenzén, brómbenzén, jódbenzén, Nitrobenzén.
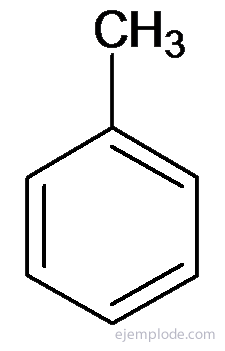
Ostatné deriváty majú špeciálne názvy, ktorým môže chýbať podobnosť s názvom skupiny substituentov. Napríklad metylbenzén je známy iba ako toluén; Aminobenzén ako anilín; Hydroxybenzén ako fenol atď.
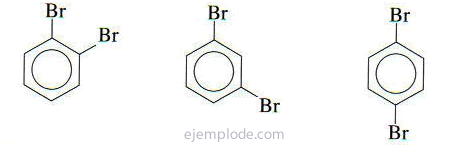
Ak sú k benzénovému kruhu pripojené dve skupiny, je potrebné nielen identifikovať, o čo ide, ale aj uviesť ich relatívne umiestnenie. Tri možné izoméry pre disubstituované benzény sú charakterizované predponami ortho, meta a para, skrátene o-, m-, p-. Napríklad: o-DiBrombenzén, m-DiBrombenzén, p-DiBrombenzén.
Ak je jedna z dvoch skupín typu, ktorý dáva molekule špeciálny názov, zlúčenina sa pomenuje ako derivát tejto špeciálnej látky. Napríklad: NitroToluén, brómfenol atď.
Príklady aromatických zlúčenín
Toluén alebo metylbenzén
Etylbenzén
Izopropylbenzén
TriNitroToluén alebo TNT
Anilín alebo aminobenzén
Kyselina benzoová
Kyselina glutámová alebo kyselina paraaminobenzoová
Kyselina toluénsulfónová
Fenol alebo hydroxybenzén
Brómfenol
Trichlórbenzén
Benzénfenyléter
Jódbenzén
Brómbenzén
