Príklad chemických javov
Chémia / / July 04, 2021
Chémia študuje zložky hmoty, zlúčeniny, ktoré tvoria, a ich možné kombinácie produkty vznikajúce z týchto kombinácií a ich štruktúra a javy, ktoré ich vytvárajú, urýchľujú alebo spomaľujú úpravy. A Chemický jav je taký, pri ktorom dve alebo viac látok prechádza zmenou, ktorá mení ich vnútornú štruktúru, čo vedie k vzniku jednej, dvoch alebo viacerých látok, odlišné od pôvodnej veci.
Na rozdiel od fyzikálnych javov, pri ktorých sú zmenené niektoré vlastnosti predmetov, ale vždy ide o rovnakú látku resp zlúčenina, vo fyzikálnych javoch sa mení štruktúra látok, takže vo výsledku zostávajú iné látky odlišné od originály. To znamená, že všetky chemické javy sú chemické reakcie, ktorých výsledkom je jedna alebo viac látok, ktoré sa molekulárne líšia od pôvodnej látky alebo látok.
Druhy chemických javov:
Chemické javy možno klasifikovať vo vzťahu k výsledku nasledovne:
Syntéza
Dve alebo viac zlúčenín sa spojí a vytvoria zložitejšiu zlúčeninu.
Rozklad
Komplexná zlúčenina sa rozkladá a vytvára jednoduchšie molekuly.
Posunutie
Jeden z prvkov alebo radikál reagujúcich molekúl sa stáva súčasťou druhej molekuly, s ktorou reaguje.
Dvojité rolovanie
Reagujúce molekuly si vymieňajú prvok alebo radikál a vznikajú tak dve rôzne molekuly, na ktoré reagovali.
Čo sa týka reakcií ako chemických javov, môžeme spomenúť nasledujúce:
Oxidácia
Oxidácia je reakcia, pri ktorej sa kyslík spojí s iným prvkom, pričom v prípade kovov vznikne oxid a v prípade, že sa spojí s nekovovými prvkami, kyslíkatá kyselina. Reakcia je pomalá a teplota materiálu sa nezvyšuje.

Spaľovanie
Spaľovanie je forma rýchlej oxidácie, pri ktorej sa tiež vydáva svetlo a teplo, to znamená, že ide o exogénnu reakciu.
Alkalizácia
Je to vtedy, keď sa kov kombinuje s hydroxylovým zvyškom (zvyšok s formou -OH).
Okyslenie
Je to vtedy, keď sa kombinuje nekovový prvok s vodíkom
Neutralizácia
Je to kombinácia hydroxidu s kyselinou, ktorá vedie k tvorbe vody a soli.
Zníženie
Je to eliminácia kyslíka z oxidu, aby sa získal čistý kov, reakciou s vodíkom z kyseliny.
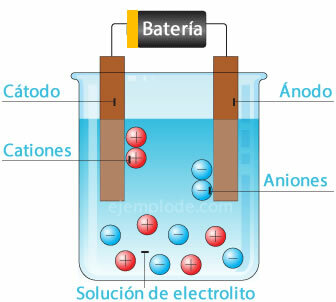
Ionizácia
Pri rozpustení soli vo vode sa prvky, ktoré ju tvoria, rozdelia na atómy s elektrickými nábojmi, ktoré môžu byť pozitívne (katión) alebo negatívne (anión). Tieto typy roztokov sa nazývajú elektrolyty.
Elektrolýza
Keď elektrický prúd prechádza elektrolytom, spôsobuje elektrina odlomenie atómov z vody. vodíkový ión s kladným nábojom smerujúci k zápornému pólu (katóde) a kyslík so záporným nábojom smerujúci k pólu kladný (anóda). Keď sa elektrolýza aplikuje v kyseline, jedným z účinkov je vytesnenie kovového prvku k anóde.
Katalýza
Dve látky, ktoré za všeobecných podmienok nereagujú alebo reagujú veľmi pomaly, môžu reagovať v veľmi rýchlo v prítomnosti tretej látky, ktorá nebude podliehať zmenám pred ani počas reakcia. Tento typ látky sa nazýva katalyzátory.
Kvasenie
Jedná sa o získanie chemickej zmeny, najmä v organických zlúčeninách, pôsobením baktérií.
Príklad chemických javov:
1. Nenatretý gril príde do styku s kyslíkom vo vzduchu a vo vode a začne na ňom byť hrdza (oxidácia).
2. Priblíženie dreva k ohňu spôsobí, že horí, čo spôsobí niektoré molekuly uhlíka, ktoré ho tvoria rýchlo zmiešať s kyslíkom, uvoľniť oxid uhličitý a nechať zvyšky spáleného dreva a sadzí (spaľovanie)
3. Rozklad potravy je spôsobený tráviacim účinkom baktérií, ktoré menia chemickú štruktúru zložiek. (Fermentácia).
4. Autobatéria vyrába elektrinu reakciou medzi elektrolytom a kovovými článkami, s ktorými sa formuje, čo spôsobuje uvoľňovanie iónov, ktoré vyrábajú elektrinu. Na jeho nabitie vykoná prúdový prúd elektrolytickú akciu, ktorá vráti ióny na dosky.
5. Plyny produkované automobilovým motorom sú stabilné a ťažko sa rozkladajú po tom, čo opustili motor a dosiahli izbovú teplotu. Katalyzátor obsahuje platinovú penu, ktorá sa po zahriatí na približne 500 ° C umožňujú plynom rozpadnúť sa na jednoduchšie zlúčeniny bez toho, aby bola platina úpravy.
6. Rozpustením soli vo vode sa štiepi na ióny sodíka a chlóru.
7. Šumenie, ku ktorému dôjde, keď zmiešate citrónovú šťavu so sódou bikarbónou, je neutralizačnou reakciou.
8. Keď krvácame, krv získava tmavšiu farbu v dôsledku oxidácie železa nachádzajúceho sa v červených krvinkách. Aj preto je venózna krv tmavšia a arteriálna krv jasnejšia.
9. Chrómovanie automobilových dielov využíva elektrolýzu na nanášanie chrómu na kovovú časť, ktorá sa chrómuje.
10. Pri trávení ako chemickom jave účinkuje kyselina chlorovodíková na potraviny rozkladom komplexné molekuly, ktoré ich tvoria, na menšie molekuly, ktoré sa ľahšie absorbujú do molekuly črevo.



