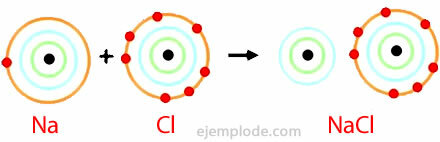
Príklad iónového zväzku
Chémia / / July 04, 2021
Iónová väzba je daná prítomnosťou katiónu a aniónu, chemických látok s elektrickými nábojmi opačných znakov. Je definovaná ako elektrostatická sila, ktorá viaže ióny v iónovej zlúčenine.
Atómy prvkov s nízkou ionizačnou energiou majú tendenciu vytvárať katióny. Naproti tomu osoby s vysokou afinitou k elektrónom majú tendenciu vytvárať anióny.
Alkalické kovy a kovy alkalických zemín s väčšou pravdepodobnosťou tvoria katióny v iónových zlúčeninách a halogény a kyslík s najväčšou pravdepodobnosťou tvoria anióny. Dôsledkom toho je zloženie veľkého množstva iónových zlúčenín výsledkom kombinácie kovu skupiny IA alebo IIA a halogénu alebo kyslíka.
Napríklad pri reakcii medzi lítiom a fluórom vzniká lítium fluorid, jedovatý biely prášok, ktorý sa používa na zníženie teploty topenia spájky a na výrobu keramiky. Elektrónová konfigurácia lítia je 1 s2, 2s1a fluór je 1 s2, 2s2, 2 str5. Keď tieto atómy prídu do kontaktu, valenčný elektrón 2 s1 Lítium sa prevedie na atóm fluóru.
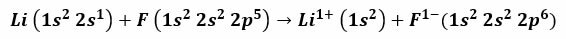
Je možné predpokladať, že postup začína odpojením lítiového elektrónu a jeho ionizáciou sa dosiahne kladná valencia 1+. Pokračuje príjmom tohto elektrónu fluórom, ktorý mu dodáva negatívny náboj. Nakoniec vznikne iónová väzba elektrostatickou príťažlivosťou. Zlúčenina fluoridu lítneho bude elektricky neutrálna.
Mnoho bežných reakcií vedie k tvorbe iónových väzieb. Napríklad spaľovaním vápnika v kyslíku vzniká oxid vápenatý:
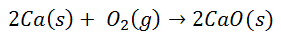
Molekula dvojatómového kyslíka sa rozdeľuje na dva jednotlivé atómy. Potom dôjde k prenosu dvoch elektrónov z atómu vápnika na každý atóm kyslíka. Oba potom budú mať príslušné náboje: pre vápnik 2+ pre každý atóm a pre kyslík 2 pre každý atóm. Po konečnom naviazaní je molekula oxidu vápenatého elektricky neutrálna.
Mriežková energia iónových zlúčenín
S hodnotami ionizačnej energie a elektrónovej afinity prvkov je možné predpovedať čo prvky tvoria iónové zlúčeniny, ale je tiež potrebné vyhodnotiť stabilitu tohto typu zlúčeniny.
Ionizačná energia a elektrónová afinita sú definované pre procesy, ktoré sa vyskytujú v plynnej fáze, aj keď všetky iónové zlúčeniny sú pevné pri 1 atmosfére tlaku a 25 ° C. Pevný stav je veľmi odlišný stav, pretože každý katión je obklopený konkrétnym počtom aniónov a naopak. V dôsledku toho celková stabilita tuhej iónovej zlúčeniny závisí od interakcií všetkých iónov, nielen od interakcie katiónu s aniónom.
Kvantitatívne meranie stability akejkoľvek iónovej tuhej látky je jej mriežková energia, ktorá je definovaná ako Energia potrebná na úplné oddelenie móla pevnej iónovej zlúčeniny na jej ióny v plynnom stave.
Born-Haberov cyklus na určenie mriežkovej energie
Nie je možné priamo merať mriežkovú energiu. Ak sú však známe štruktúry a zloženie iónovej zlúčeniny, je možné vypočítať jej mriežkovú energiu pomocou Coulombovho zákona, ktorý uvádza, že potenciálna energia medzi dvoma iónmi je priamo úmerná súčinu ich nábojov a nepriamo úmerná vzdialenosti medzi nimi. Prestať.
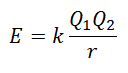
Pretože náboj katiónu je kladný a náboj aniónu je záporný, bude mať produkt negatívny výsledok v podobe energie. To predstavuje exotermickú reakciu. Preto je potrebné dodať energiu na zvrátenie procesu.
Je tiež možné nepriamo určiť mriežkovú energiu, ak sa predpokladá, že iónová zlúčenina vzniká v niekoľkých stupňoch. Tento postup je známy ako Born-Haberov cyklus, ktorá sa týka mriežkových energií iónových zlúčenín s ionizačnými energiami, elektronickou afinitou a ďalšími atómovými a molekulárnymi vlastnosťami. Táto metóda je založená na Hessovom zákone o algebraickom súčte chemických reakcií a vyvinuli ju Max Born a Fritz Haber. Born-Haberov cyklus definuje rôzne fázy, ktoré predchádzajú vzniku iónovej pevnej látky.

Chlorid sodný
Chlorid sodný je iónová zlúčenina s teplotou topenia 801 ° C, ktorá vedie elektrinu v roztavenom stave a vo vodnom roztoku. Kamenná soľ je jedným zo zdrojov chloridu sodného a nachádza sa v podzemných ložiskách, ktoré majú často hrúbku niekoľko sto metrov. Chlorid sodný sa tiež získava z morskej vody alebo zo soľanky (koncentrovaný roztok NaCl) solárnym odparovaním. V prírode sa tiež nachádza v mineráli nazývanom halit.

Chlorid sodný sa používa viac ako akýkoľvek iný materiál na výrobu anorganických chemických zlúčenín. Svetová spotreba tejto látky je asi 150 miliónov ton ročne. Chlorid sodný sa používa hlavne na výrobu ďalších anorganických chemických zlúčenín, ako je plynný chlór, hydroxid sodný, kovový sodík, plynný vodík a uhličitan sodný. Používa sa tiež na topenie ľadu a snehu na diaľniciach a cestách.