Príklad Daltonovho zákona
Chémia / / July 04, 2021
Anglický vedec John Dalton (1766-1844) bol fyzik a chemik, ktorý mnohokrát prispel ku kompresii a klasifikácii prvkov a chemikálií. Medzi jeho hlavné príspevky patrí prvý model znázornenia atómov a zlúčenín prostredníctvom grafického znázornenia. Sformuloval tiež takzvaný „zákon viacerých pomerov“, ktorý je tiež známy ako Daltonov zákon.
Louis Proust (1754-1826) formuloval pre chemické kombinácie „zákon konštantných rozmerov“, v ktorom zhromažďuje pozorovanie, že chemikálie sa vždy kombinujú v rovnakom pomere a vytvárajú rovnaké zlúčeniny. To znamená, že ak sa kombinujú vodík a kyslík, budú sa kombinovať vždy v rovnakom pomere, aby sa vytvorila voda. Tento zákon však nevysvetľoval, ako existujú rôzne zlúčeniny zložené z rovnakých látok.
So svojou atómovou teóriou si Dalton uvedomil, že keď sa spoja niektoré jednoduché látky, môžu to urobiť vyrábajú sa rôzne zlúčeniny a že množstvá jednej z látok sa menia v proporcionálnom pomere jednoduché.
Daltonov zákon je uvedený takto: Hmotnosti prvku, ktorý sa spája s rovnakým množstvom druhého, aby vytvorili rôzne chemické zlúčeniny, sa líšia podľa veľmi jednoduchého vzťahu.
To znamená, že ak vieme, ako sa látky kombinujú v jednoduchých pomeroch, a množstvo jednej z látok zostáva nemenné a iné látku dáme v jednoduchom pomere, ako pomer 2, 3 alebo 4 k pôvodnému pomeru, v každom prípade získame látku rôzne. Stáva sa to napríklad pri kombinácii fosforu, vodíka a kyslíka.
Ak spojíme 1 objem fosforu, 3 objemy vodíka a 2 objemy kyslíka, získame kyselinu fosforečnú:
P + 3H + 2O -> PO2H3
Ak v predchádzajúcej reakcii zmeníme iba kyslík v jednoduchom pomere 2, získame kyselinu fosforečnú:
P + 3H + 4O -> PO4H3
Je potrebné vziať do úvahy, že v tejto dobe ešte nebol známy koncept atómovej valencie, takže nevedelo sa presne, prečo je možné niektoré látky kombinovať v rôznom pomere a iné nie.
Príklad Daltonovho zákona
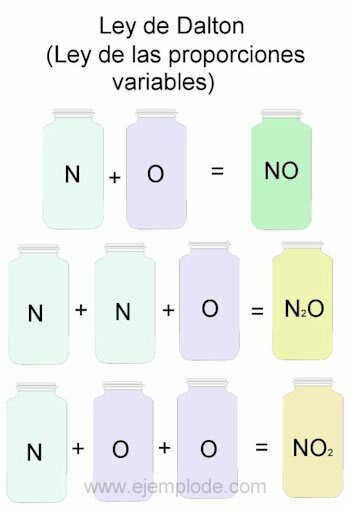
Na ilustráciu Daltonovho zákona budeme brať ako referenciu kombinácie dusík (N) a kyslíka (O).
Keď sa skombinujú v rovnakom pomere, to znamená jeden po druhom, dostaneme oxid dusnatý:
N + O -> NIE
Ak udržíme konštantný objem dusíka a zmeníme kyslík o 2, získame peroxid dusíka:
N + 2O -> NIE2
Ak teraz na základe oxidu dusnatého udržujeme konštantný kyslík a meníme objem dusíka o 2, získame oxid dusný:
2N + O -> N2ALEBO
Ak bol článok pre vás užitočný, nezabudnite nám dať +1.



