20 Primeri kemijskih pojavov
Miscellanea / / July 04, 2021
The kemični pojavi (ali kemijske reakcije) so tisti pojavi, pri katerih se v snovi pojavijo spremembe, nastanejo nove snovi, imenovane "produkti", in druge, imenovane "reaktanti", se razgradijo. Na primer: lesena gniloba, kurjenje papirja, kompostiranje.
Kemične reakcije so lahko spontano (reakcije, ki se pojavijo brez potrebe po energiji ali katalizatorjih) oz ne spontano (reakcije, pri katerih je potreben prispevek energije, katalizatorji ali kakšen zunanji poseg). Velikokrat je za reakcijo potrebno, da imajo reagenti a temperatura posebne, a pH nastavljena vrednost tlaka itd.
Morda je tudi bistvenega pomena nadzor nad hitrost na katere pride do kemičnih reakcij. The katalizatorji So snovi, ki jih kemični reakciji dodajo za povečanje hitrosti, zaviralci pa snovi, ki upočasnijo hitrost kemijskih reakcij. Drugi dejavniki, ki vplivajo na hitrost kemijske reakcije, so temperatura, tlak, koncentracija reaktantov in narava same reakcije.
Lahko vam postreže:
Vrste kemičnih pojavov
Kemične reakcije so lahko:
Anorganske reakcije. Posredovati anorganske spojine in jih je mogoče razvrstiti glede na:
- Pomen, v katerem pride do reakcije.
-
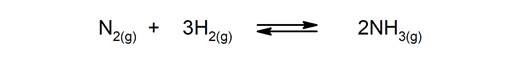
Reverzibilne reakcije. Pojavljajo se v obe smeri, zato se produkti lahko razgradijo in znova tvorijo reaktante.
-
Nepovratne reakcije. Zgodijo se le v eno smer.

-
Reverzibilne reakcije. Pojavljajo se v obe smeri, zato se produkti lahko razgradijo in znova tvorijo reaktante.
- Vrsta delca, ki reagira.
-
Kislinsko-bazične reakcije. Pojavi se prenos H iona+.

-
Reakcije redukcije oksidacije. Eden od reaktantov oksidira (poveča njegovo število oksidacija), medtem ko se drugi zmanjša (njegovo oksidacijsko število se zmanjša). V teh reakcijah pride do prenosa elektronov.

-
Kislinsko-bazične reakcije. Pojavi se prenos H iona+.
- Hitrost reakcije.
-
Hitre reakcije. Pojavijo se v zelo kratkem času.
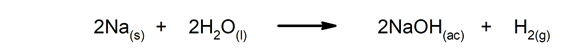
-
Počasne reakcije Dolgo trajajo.
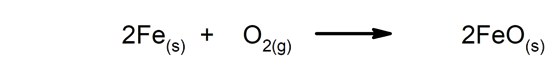
-
Hitre reakcije. Pojavijo se v zelo kratkem času.
- Oblika energije, ki jo oddaja ali absorbira.
-
Eksotermne reakcije. Ko se pojavijo, sproščajo toploto.
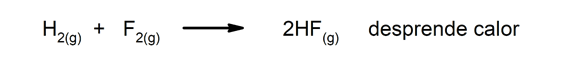
-
Endotermne reakcije. Ko se pojavijo, absorbirajo toploto.

-
Eksluminatne reakcije. Ko se pojavijo, oddajajo svetlobo.

-
Endoluminaste reakcije. Da bi se zgodilo, potrebujejo svetlobo.

-
Eksotermne reakcije. Ko se pojavijo, sproščajo toploto.
- Tip preobrazbe.
-
Sintezne ali adicijske reakcije. Dve snovi se združita v novo snov.
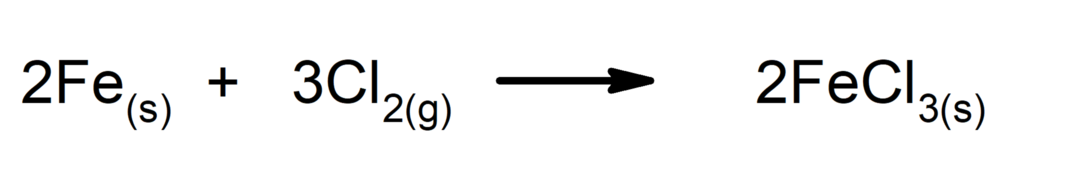
-
Reakcijske reakcije. Ena ali več snovi se razgradi na najpreprostejše sestavine.
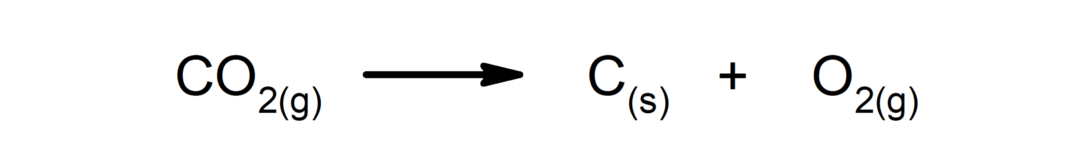
-
Reakcije izpodrivanja ali zamenjave. En element ali spojina nadomesti drugega v spojini in ga sprosti.
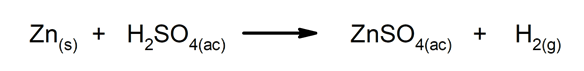
-
Reakcije dvojne substitucije. Dve spojini hkrati izmenjujeta elemente ali spojine.

-
Sintezne ali adicijske reakcije. Dve snovi se združita v novo snov.
Organske reakcije. So reakcije, pri katerih posegajo organske spojine. Imajo veliko klasifikacij, ki temeljijo na vrsti organske spojine, ki reagira, in vrsti reakcije, v kateri pride. Nekaj primerov je:
-
Halogeniranje alkanov. Vodik je nadomeščen z a alkan s halogenom.
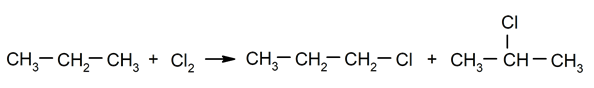
-
Izgorevanje alkanov. Alkan reagira s kisikom in tvori ogljikov dioksid in vodo, če je izgorevanje končano.
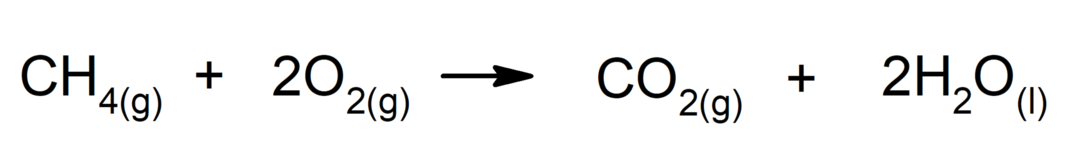
-
Halogeniranje alkeni. Halogeni so nadomeščeni za enega ali oba vodika ogljika, ki sta vključena v dvojno vez.
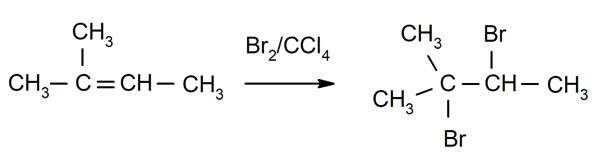
-
Hidrogeniranje alkenov. Vodiki se dodajo ogljikom, ki sodelujejo v dvojni vezi, da nastane ustrezen alkan.
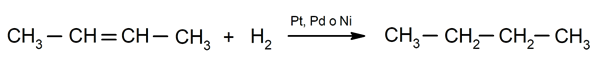
Pomen kemijskih pojavov
Številni kemični pojavi ohraniti življenje živih bitij, kot je prebava pri ljudeh in živali, fotosinteza pri rastlinah in dihanje pri obeh.
Še en zelo pomemben kemični postopek, zlasti v življenju mikroorganizmi, ali je fermentacija, ki se običajno uporablja pri izdelavi hrano kot so siri, jogurti, vina in piva.
Vse porast in rast a živo bitje Vključuje kemične reakcije, ki se v njem odvijajo, včasih pa jih spodbudijo določene okoljske razmere.
Primeri kemijskih pojavov
Okoli nas obstajajo številni primeri kemičnih pojavov ali procesov, ki jih vključujejo:
- Lesna gniloba
- Izgorevanje papirja
- Odpornost na antibiotiki bakterije
- Mleko, ki postane kislo
- Razkuževanje rane z alkohol
- Uporaba sadne soli za boj proti zgagi
- Gorenje sveče
- Strjevanje krvi
- Mišična utrujenost po intenzivni vadbi
- Smrt žuželke z insekticidi
- Pridobivanje sira roquefort
- Pridobivanje jabolčnika
- Pridobivanje jogurta
- Kompostiranje
- Ensilage
- Pridobivanje bioetanola iz melase
- Otekle pločevinke
- Gnilo jajce
- Rjavenje rešetke
- Pridobivanje biodizla iz palmovega olja
Kemični pojavi v industriji
Nekateri kemični pojavi so tudi ključni priindustriji. Za začetek zgorevanje ogljikovodiki (na primer bencin, dizelsko gorivo ali kerozin) proizvaja Energija za upravljanje strojev, ki obvladujejo nešteto industrijskih procesov.
Po drugi strani pa jeklarska industrija, papir, plastika, gradbeni materiali, barve, zdravila, izdelki za agro itd., temeljijo na različnih kemijskih pojavih, kot so galvanizacija, elektroliza in mnogi drugi več.
Generacija novih virov energije (kot biodizel in bioetanol) prav tako temelji na tej vrsti pojava.
Preobrazba energije
V kemijskih pojavih je običajno, da obstajajo preoblikovanje energije. Na primer, ko se kemična energija, ki jo vsebujejo vezi določene molekule, pretvori v električno ali sprosti kot toplota (to se zgodi pri eksotermnih pojavih, na primer pri mešanju klorovodikove kisline s cinkom), pride do Energija. Enako se zgodi, ko se svetlobna energija zajame in pretvori v kemično energijo.
Nekateri kemični procesi zahtevajo vročino in se imenujejo "endotermni". Drugi zahtevajo prisotnost katalizatorjev ali kofaktorjev.

