100 primerov kemičnih elementov
Miscellanea / / November 13, 2021
The kemični elementi so vrsta zadeve, ki po nobenem postopku oz kemijska reakcija lahko jih reduciramo ali razstavimo na druge enostavnejše elemente. Iz tega razloga lahko rečemo, da je element vse zadeva Narejeno v atomi istega in edinstvenega razreda, to je atomov, ki imajo enako atomsko število (enako število protonov), čeprav imajo različno atomsko maso. Na primer: žveplo, bor, krom, kositer.
Prvo definicijo kemičnega elementa je uvedel Lavoisier pri Traite Élémentaire de Chimie, leta 1789. Že v 18. stoletju je Lavoisier preproste snovi razdelil v štiri skupine:
Periodični sistem elementov
Danes se poznajo 118 kemičnih elementov. Vsi so zbrani, razvrščeni in organizirani glede na številne njihove lastnosti v grafični shemi, znani kot periodični sistem elementov, ki jo je prvotno ustvaril ruski kemik. Dimitrij Mendeljejev leta 1869. Periodični sistem je sestavljen iz 18 skupin (stolpcev) in 7 obdobij (vrstic), v katerih se nahajajo kemični elementi.
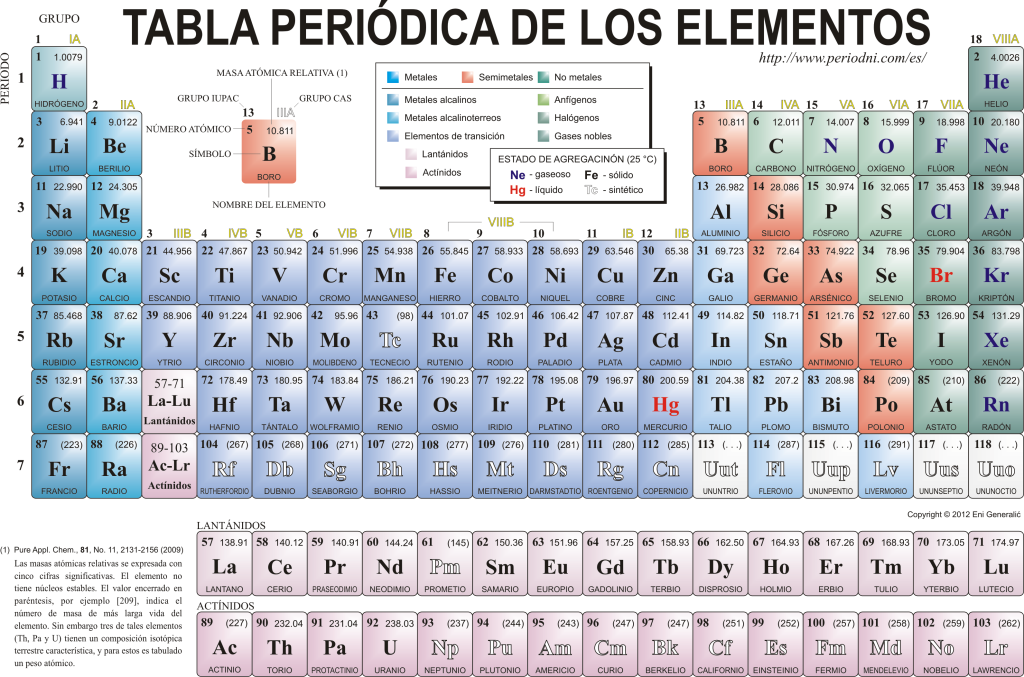
The glavne skupine ki jih lahko najdete v tej tabeli so:
Alkalijske kovine (skupina 1), zemeljskoalkalijske kovine (skupina 2), družina skandijevih, ki vključuje zemlje in aktinide (skupina 3), družina titana (skupina 4), družina vanadija (skupina 5), družina kroma (skupina 6), družina mangana (skupina 7), družina železa (skupina 8), družina kobalta (skupina 9), družina niklja (skupina 10), družina bakra (skupina 11), družina cinka (skupina 12), zemeljski elementi (skupina 13), karbonidni elementi, v tej skupini so Ogljik, ki je osnova življenja na Zemlji (skupina 14), elementi, ki tvorijo dušik (skupina 15), amfigenetski elementi, vključuje kisik, temeljni element za the dihanje od živa bitja (16. skupina), halogenski elementi (17. skupina) in žlahtni plini (18. skupina).
Mnogi od teh elementov imajo stabilni ali radioaktivni izotopi, torej isti kemični element, na primer vodik (H), ima lahko več izotopov (1H, 2H, 3H). To pomeni, da ima vsak atom izotopa enako število protonov (kar pomeni, da pripada istemu kemičnemu elementu) in različno število nevtronov.
Nekateri izotopi niso stabilni (radioaktivni), tj. razpadejo v določenem času oddaja določene delce (med drugim nevtrone, fotone, alfa delce) in ustvarja druge stabilne ali radioaktivne izotope. Kemični elementi imajo lastnosti, kot je točka Vreti in to od fuzije, elektronegativnost, gostota in ionski polmer, med drugim. Te lastnosti so pomembne, ker nam omogočajo napovedovanje njegovega obnašanja, reaktivnosti itd.
Kako so elementi predstavljeni v periodnem sistemu?
Vsak kemični element je označen v Periodični sistem z uporabo določene simbolike. Prvič, v središču vsake škatle je njegov univerzalni simbol, ki je sestavljen iz enega ali dveh črke (po dogovoru, če sta dve črki, je prva napisana z velikimi, naslednja pa z malimi).
Zgoraj in na levi se pojavi v majhni pisavi su atomsko število, ki označuje količino protonov, ki jih ima ta element. Pod simbolom elementa se prikaže njegovo ime, zgoraj na levi pa njegovo ime. atomska masa relativno. Poleg tega barva, v kateri je predstavljen simbol elementa, označuje njegovo agregacijsko stanje (v skladu s predstavitvijo, uporabljeno v vsaki periodni tabeli).
Prisotni različni elementi atomski radiji spremenljivke in, ko se število protonov v jedru povečuje, večja je privlačnost, ki jo jedro izvaja na elektrone, zato se atomski polmer nagiba k zmanjšanju. Ko je atomski polmer majhen, elektrone na najbolj oddaljeni ravni oblaka jedro zelo privlači, zato ne obupajo zlahka. Nasprotno se zgodi z elementi z visokimi atomskimi polmeri: zlahka oddajo svoje zunanje elektrone.
Tako se atomski polmer povečuje od zgoraj navzdol, ko gremo skozi skupine periodnega sistema, in se zmanjšuje od leve proti desni, ko gremo skozi njihove periode.
Primeri kemičnih elementov
| Kemični element | Simbol |
| aktinij | Ac |
| aluminij | Na |
| Americij | A.M |
| Antimon | Sb |
| Argon | Ar |
| Arzen | Ace |
| Astat | Pri |
| žveplo | S |
| barij | Ba |
| berilij | Bodi |
| Berkelium | Bk |
| bizmut | Bi |
| Bohrio | Bh |
| bor | B |
| brom | Br |
| kadmij | CD |
| kalcij | AC |
| Kalifornij | Prim |
| Ogljik | C |
| Cerij | EC |
| cezij | Cs |
| klor | Cl |
| kobalt | Co |
| baker | Cu |
| Chrome | Kr |
| Curium | cm |
| Darmstadio | Ds |
| Disprozij | Dy |
| Dubnij | Db |
| Einsteinium | je |
| erbij | Er |
| skandij | sc |
| Kositer | Sn |
| Stroncij | gospod |
| Evropij | eu |
| fermij | Fm |
| Fluor | F |
| Tekma | P |
| Francius | Fr |
| gadolinij | Gd |
| Galij | Ga |
| germanij | Ge |
| Hafnij | Hf |
| Hassio | Hs |
| helij | imam |
| vodik | H |
| železo | vera |
| Holmij | Ho |
| indijski | V |
| jod | jaz |
| Iridij | Iti |
| iterbij | Yb |
| itrij | IN |
| Kripton | Kr |
| Lantan | The |
| Lawrencio | Lr |
| litij | Li |
| lutecij | pon |
| magnezija | Mg |
| mangan | Mn |
| Meitnerius | Mt |
| Mendelevij | Md |
| Merkur | Hg |
| molibden | Mo |
| neodim | Na |
| Neon | Ne |
| Neptunij | Np |
| Niobij | Opomba |
| nikelj | niti enega |
| dušik | N |
| Nobelio | št |
| Zlato | Au |
| Osmij | ti |
| Kisik | ALI |
| Paladij | P.S |
| Srebrna | Ag |
| Platina | Pt |
| Svinec | Pb |
| plutonij | Pu |
| polonij | Po |
| kalij | K |
| Prazeodim | Pr |
| Obljubi | popoldan |
| Protaktinij | Pa |
| Radio | Ra |
| Radon | Rn |
| renij | Re |
| rodij | Rh |
| Rubidij | Rb |
| Rutenij | Ru |
| Rutherfordio | Rf |
| Samarij | da |
| Seaborgio | Sg |
| Selen | Vem |
| silicij | da |
| natrij | Na |
| talij | Tl |
| tantal | Ta |
| Tehnecij | Tc |
| Telur | čaj |
| terbij | Tb |
| titan | ti |
| torij | Th |
| Tulij | Tm |
| Kopernik | Cn |
| Livermorio | Lv |
| Roentgenio | Rg |
| Ununoktij | Uuo |
| Ununpentium | Uup |
| Flerovio | Fl |
| Ununseptio | Uus |
| Ununtrij | Uut |
| uran | ALI |
| vanadij | V |
| Volfram | W |
| Xenon | Xe |
| Cink | Zn |
| cirkonij | Zr |

Sledi z:

