Definicija molekularne geometrije
Miscellanea / / January 11, 2022
Konceptualna opredelitev
To je struktura molekule, ki določa tridimenzionalno razporeditev atomov, ki jo sestavljajo v vesolju.

Kemijski inženir
Molekularne geometrije so trenutno definirane na podlagi teorija odbijanja elektronskih parov sloja Valencia (TRPECV). Ta teorija omogoča napovedovanje vedenja kemični snovi (zlasti kovalentnih) in pomaga razumeti distribucijo elektronika, kar vodi do geometrijo od molekula. To pa nam omogoča, da razumemo številne lastnosti, ki jih pridobijo snovi.
Ta teorija temelji na vrsti temeljnih stebrov, ki jih bomo pregledali in jih nato poskušali razumeti aplikacijo praksa. Prvič, vezani in nevezani (valenčni) elektroni se obravnavajo kot morje elektronov, ki imajo enako vrsto naboja, se odbijajo, zato bodo vedno locirani čim dlje od osrednjega atoma molekula.
Drugič, to "morje" elektronov ali "elektronski oblak" tvori območja z visoko gostoto elektronov, ki so sestavljeni v vezi, kjer so elektroni skupni ali v parih elektronov, ki niso skupni. Po drugi strani so vezi, ki nastanejo, lahko enojne, dvojne ali celo trojne.
Končno za odločiti molekularna geometrija, je zelo koristno imeti Lewisovo strukturo, kjer se bo preštela količina elektronskih gostot okoli osrednjega atoma in to bo dalo indikacija iz imena njegove geometrije in oblike, ki jo molekula zavzame tridimenzionalno.
Treba je opozoriti, da bodo te gostote nameščene čim dlje narazen, da bi sprejele najbolj stabilno strukturo in kjer je manj odbijanja. Tako se najprej identificira elektronska geometrija in nato molekularna geometrija.
Šest stopenj gostote
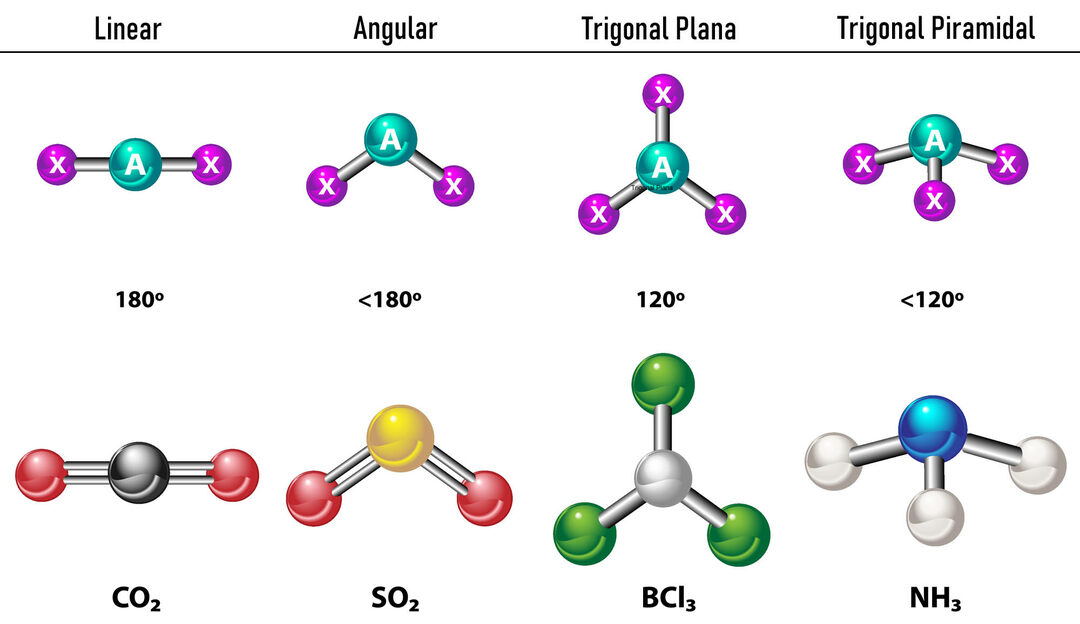
V primeru, da sta okoli osrednjega atoma dve elektronski gostoti, se vezi nahajata čim bolj narazen med njima, to je 180° drug od drugega, zato je njihova elektronska geometrija linearna in molekularno tudi linearna.
V primeru, da so okoli osrednjega atoma tri elektronske gostote, sta na voljo dve možnosti: tri vezi ali dve vezi in en nevezan par. Če obstajajo tri vezi, je elektronska geometrija Trigonalno stanovanje, s koti 120° med vezmi in molekularna geometrija ima isto ime. Zdaj, če obstaja nevezan par, se odbijata z več intenzivnost da vezani naboji zato težijo k stiskanju veznih kotov. Kot med prostim parom in vsako vezjo je 120° in elektronska geometrija je trigonalna ravnina, medtem ko je molekularna geometrija kotna.
V primeru, da so okoli osrednjega atoma štiri elektronske gostote, je elektronska geometrija tetraedrična. Če so vsi štirje pari elektronov vezani, njihova molekularna geometrija po imenu sovpada z njihovo elektronsko geometrijo in vezni kot je 109,5°. Zdaj, če je eden od parov prost, se vezni kot zmanjša (107º) in molekularna geometrija je tip Trigonalna piramida. Končno, če sta dva prosta para in dva povezana, je vezni kot 104,5°, medtem ko se molekularna geometrija imenuje Kotna.
Ko je elektronska gostota okoli osrednjega atoma pet, se imenuje a Trigonalna bipiramida njegova elektronska geometrija. Če so vse obremenitve povezane, so koti 120ºC med ekvatorialnimi členi in 90º med osnimi in ekviatorskimi. Zdaj se molekularna geometrija imenuje tudi trigonalna bipiramida, medtem ko je s štirimi povezanimi pari in enim prostim parom molekularna geometrija popačena in tvori dobro znano "rocker«, Tam je ime, ki ga pridobi Izkrivljen tetraeder. Medtem ko sta dva od petih parov elektronov prosta in so trije povezani, ima geometrijo v obliki črke "T" in njegovo ime je prav zaradi strukture. Končno, če je obratna, trije prosti pari in dva vezana naboja, je molekularna geometrija linearna.
Končno je okoli osrednjega atoma šest elektronskih gostot in nastane oktaeder, od tod tudi njegovo ime v elektronski geometriji. Podobno je molekularna geometrija poimenovana, če so vsi njeni pari povezani. Če imate pet povezanih parov in en prosti par, je molekularna geometrija piramida s kvadratno bazo. Če imate štiri vezane pare in dva prosta para, je molekularna geometrija Kvadratno stanovanje.
Slika: Sladka narava
Teme iz molekularne geometrije


