Koncept v definiciji ABC
Miscellanea / / April 22, 2022
definicija koncepta
Azeotropi so mešanice kemičnih spojin z določeno sestavo, ki vrejo pri določenih temperaturah. Osnovna značilnost zmesi je, da se zmes obnaša, kot da bi bila ena sama čista snov, pri čemer ohranja svoje lastnosti in omogoča enostavno rokovanje.

Kemijski inženir
Mešanico lahko dajeta dve ali več komponent in njene sestavo enako je tako v tekoči kot v plinasti fazi, kar ustvarja podobnosti s čistimi snovmi. Iz tega je zlahka razbrati, da te zmesi ni mogoče ločiti na njene sestavine s postopki, kot je npr frakcijske destilacije, saj bo, kot je navedeno zgoraj, ohranil svoje deleže in se obnašal, kot da bi bil komponento.
Druga značilnost je, da je vrelišče te zmesi lahko višje, nižje ali celo enako vrelišču ene od njenih sestavin. Ko azeotrop zavre pri a temperaturo največjega vrelišča je znan kot maksimalni azeotrop in ko to počne pri najnižji možni temperaturi, je znan kot minimalni azeotrop. To pomeni, da ima minimalni azeotrop nižje vrelišče kot njegove čiste komponente in obratno z največjim azeotropom. Na primer, v mešanici metanol - benzen je azeotrop minimalen (0,61 benzena - 0,39 metanola v frakcijah molar), katerega vrelišče je 58 °C, v rezervoarju, kjer je vrelišče benzena 80 °C in vrelišče metanola 65°C
Najmanjši in največji azeotropi
Zdaj... od kod prihaja azeotrop? Ko pride do odstopanja od zakon Raoult, to pomeni, da parni tlak azeotropne zmesi ni neposredno povezan z njeno molsko frakcijo, ampak takrat, ko se pojavi koncept azeotropne zmesi. Ta odstopanja nastanejo, ko se komponente bistveno privlačijo ali odbijajo druga drugo, torej so medmolekulske sile v različnih spojinah zelo različne.
Ko je odstopanje pozitivno, imamo najmanjši azeotrop, če je odstopanje negativno, pa največji azeotrop. Da bi bolje razumeli ta koncept, si oglejmo nekaj grafik:
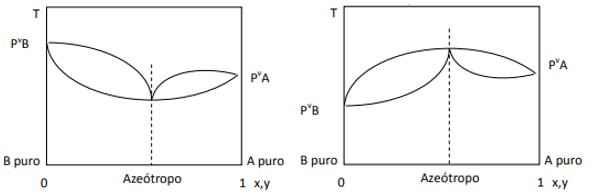
Tukaj opazimo, da bi morali biti parni tlaki čistih komponent, če bi bila zmes idealna, po Raoultovem zakonu združeni z ravno črto, saj no, obstaja odstopanje od tega zakona, ki povzroči nastanek minimalnih in maksimalnih azeotropov, odvisno od tega, ali obstaja večja ali manjša afiniteta med komponente. Ko je odstopanje od Raoultovega zakona negativno, kot na sliki na levi, je minimalno pri diagram tlaka, ampak maksimum v temperaturnem diagramu (torej azeotrop maksimuma). Po drugi strani, če je odstopanje pozitivno glede na Raoultov zakon, bo to maksimum v tlaku vs. sestava, vendar minimum v diagramu temperature vs. sestava (tu imamo minimalni azeotrop). Ne zamenjujte diagramov tlak in. sestava in temperatura vs. sestavo.
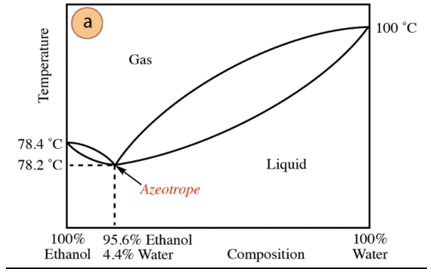
V primeru mešanice etanol-voda obstaja minimalni azeotrop, katerega sestava je 95,6 % etanola in 4,4 % vode. Temperatura vrelišča azeotropne zmesi je za 78,2 °C nižja od vrelišča čistih komponent. Recimo, da destilirate mešanico vode in etanola z visoko vsebnostjo vode (blizu 100 %). Ne bo mogoče dobiti čistega alkohola, saj bodo v vsaki fazi destilacije pridobljene večje frakcije. etanola, vendar nikoli ne doseže 100%, se bo postopoma približal sestavi azeotropne zmesi (najnižja točka Spodaj). Zato ima tako kot voda nagnjenost k tvorbi minimalnih azeotropov organske spojine (glede na vrsto medmolekularnih sil, ki delujejo), je potrebno predhodno odstraniti vodo iz zmesi, da dobimo čisto spojino. Ali, ko je azeotrop pridobljen, metode ekstrakcijo dodatne vode.
Glede na zgoraj navedeno ni naključno najti alkohola (v supermarketu in lekarna) pri 95 % je najcenejši izdelek, ki ga je mogoče dobiti. Za pridobitev čistega alkohola je treba azeotrop "razbiti". tehniko dodatno, kot je uporaba sušilnih sredstev ali azeotropne destilacije. Azeotropna destilacija je sestavljena iz dodajanja dodatne komponente zmesi, ki deluje z zajemom in z interakcijo s katero koli komponento zmesi (večja afiniteta) lahko odstranimo iz zmesi.
Teme v azeotropih