30 primerov alkoholov
Primeri / / November 06, 2023
The alkoholi so organske kemične spojine ki vsebujejo v svoji strukturi hidroksilno funkcionalno skupino (- OH), vezano na ogljik (- C). Skupina (- C – OH) se imenuje "karbinol". Nekateri primeri alkoholov so: metanol, etanol in 1-propanol.
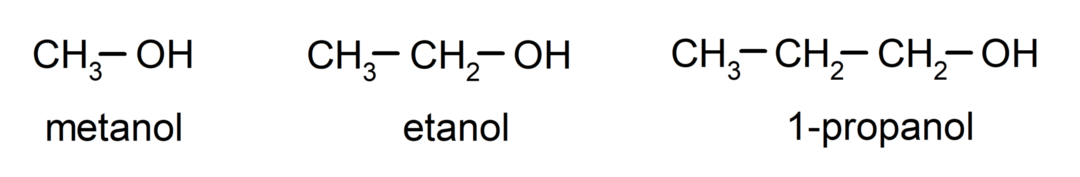
Alkoholi so kemične spojine z različnimi uporabami v vsakdanjem življenju, saj imajo antibakterijske in antiseptične lastnosti. Po drugi strani pa so lahko ob nenadzorovanem zaužitju nevarni za zdravje ljudi.
Prav tako ljudje ne morejo zaužiti vseh alkoholov.
- Glej tudi: Amini in ketoni
Vrste alkoholov
Glede na število ogljikovih atomov, na katere je vezan ogljikov atom, ki ima vezano hidroksilno skupino, je lahko alkohol:
- Primarni alkohol. Atom ogljika, ki ima vezano hidroksilno skupino, je prav tako vezan na en atom ogljika. Na primer:
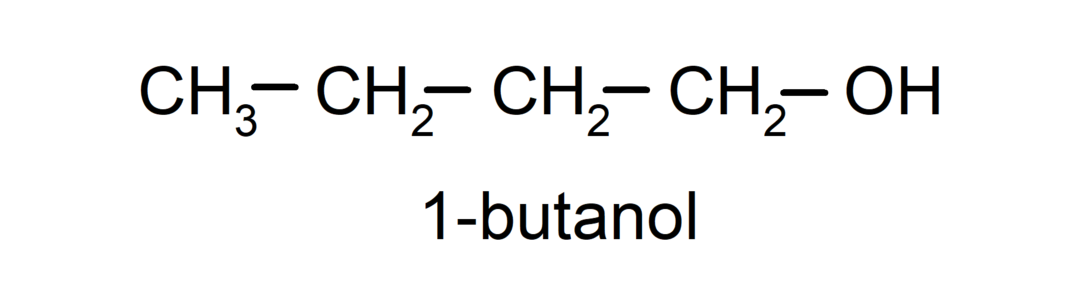
- Sekundarni alkohol. Ogljikov atom, na katerega je vezana hidroksilna skupina, je prav tako vezan na dva druga ogljikova atoma. Na primer:
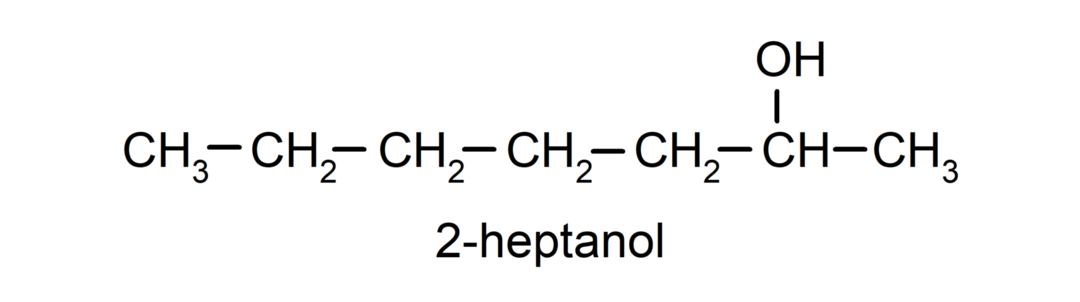
- Terciarni alkohol. Atom ogljika, ki ima vezano hidroksilno skupino, je prav tako vezan na tri atome ogljika. Na primer:
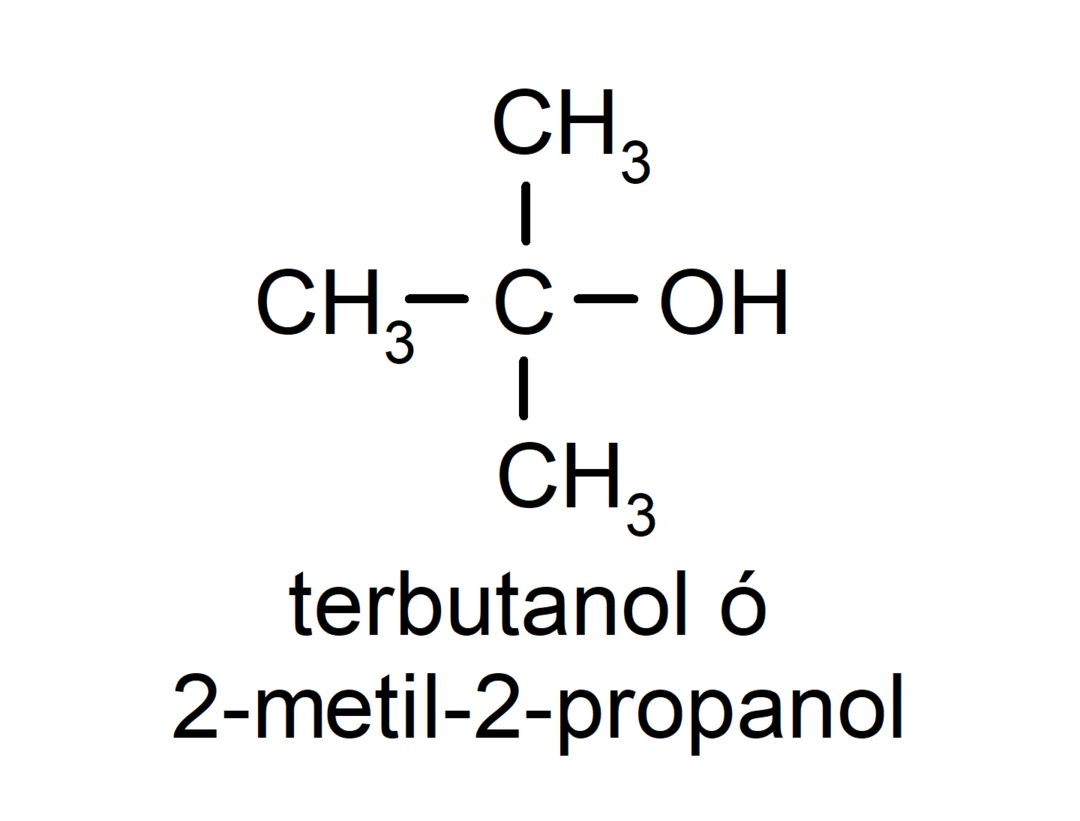
Alkohol je lahko glede na število hidroksilnih skupin:
- Diol. V svoji strukturi ima dve hidroksilni skupini. Na primer:
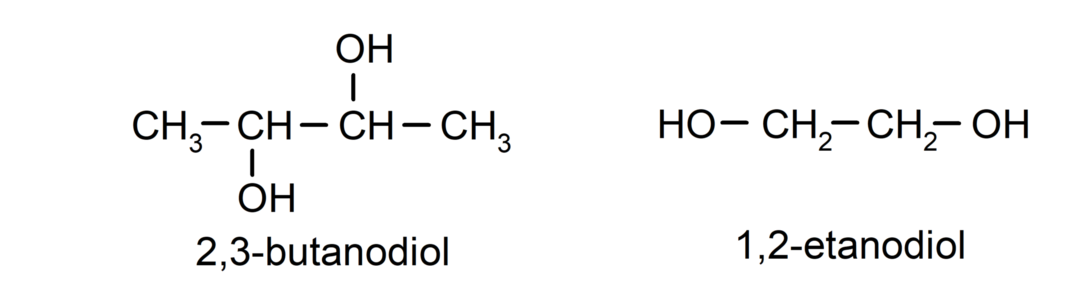
- Triol. V svoji strukturi ima tri hidroksilne skupine. Na primer:
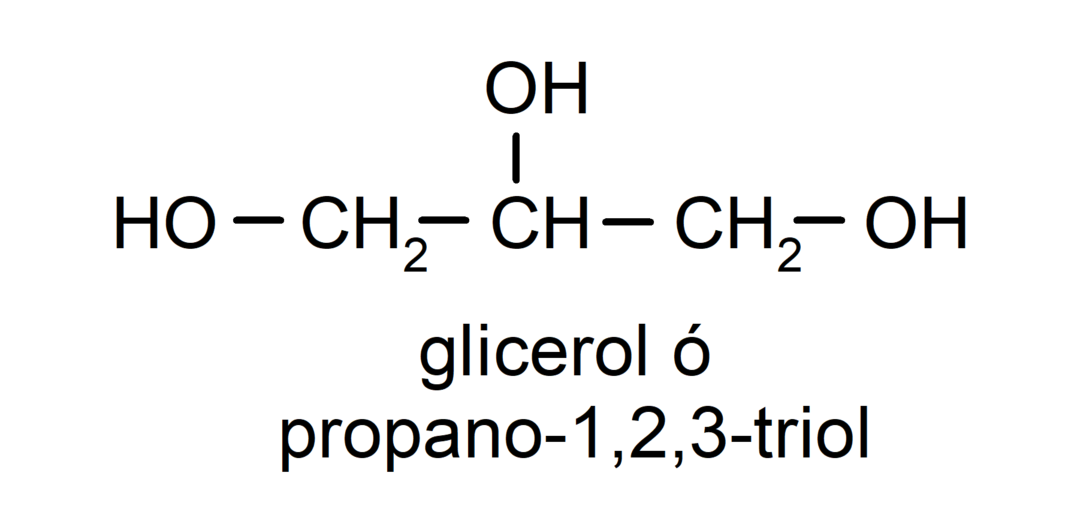
- Polialkohol. V svoji strukturi ima veliko hidroksilnih skupin. Na primer:
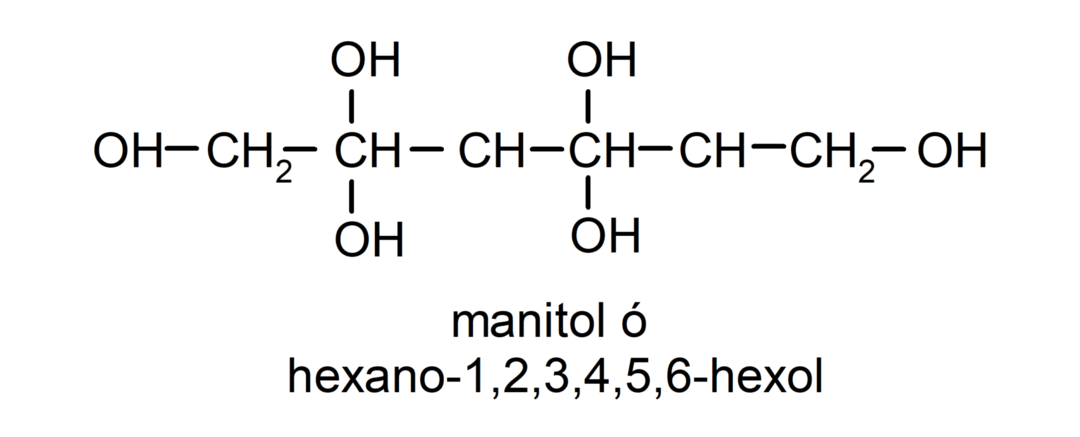
Fizikalne lastnosti alkoholov
Nekatere fizikalne lastnosti alkoholov so:
- Vrelišče. Vrelišče v alkoholih je precej visoko zaradi prisotnosti hidroksilne skupine, ki omogoča tvorbo vodikovih vezi. Nadalje, več hidroksilnih funkcionalnih skupin je prisotnih v ogljikovi verigi, višja je Vrelišče alkoholov.
- Polarnost. Alkoholi so precej polarne spojine.
- Topnost. Nizkomolekularni alkoholi so topni v vodi. Po drugi strani pa večja kot je ogljikova veriga alkoholov, manjša je njihova topnost v vodi. Poleg tega več kot imajo alkoholi hidroksilnih skupin, večja je njihova topnost v vodi.
- Agregatno stanje. Večina alkoholov je pri sobni temperaturi (25 °C) tekoča in ima značilen vonj.
Kemične lastnosti alkoholov
Nekatere kemijske lastnosti alkoholov so:
- Alkoholi se obnašajo kot kisline in baze.. Njihovo obnašanje kot kisline lahko vidimo v reakcijah z aktivnimi kovinami, pri katerih se sprošča vodikov plin in tvorijo alkoksidi.

Njihovo obnašanje kot baz lahko vidimo v reakcijah, kot je reakcija metanola z vodikovim bromidom, da nastane metiloksonijev bromid.
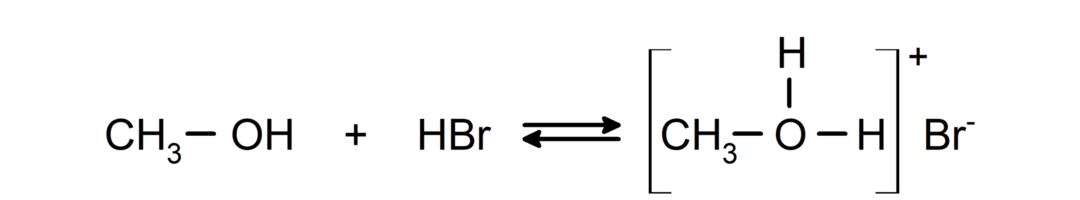
- Alkoholi so podvrženi reakcijam halogeniranja. Reagirajo z vodikovimi halogenidi in tvorijo alkilne halogenide.
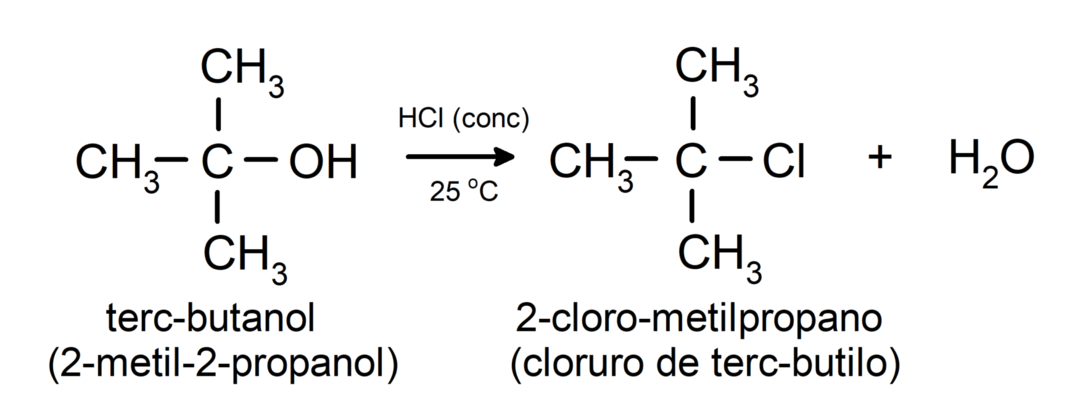
-
Alkoholi so podvrženi oksidacijskim reakcijam ko reagirajo z določenimi oksidacijskimi spojinami. Produkti oksidacijskih reakcij so odvisni od vrste alkohola, ki reagira, to je, ali je primarni, sekundarni ali terciarni.
Oksidacija primarnega alkohola v aldehid ali karboksilno kislino.
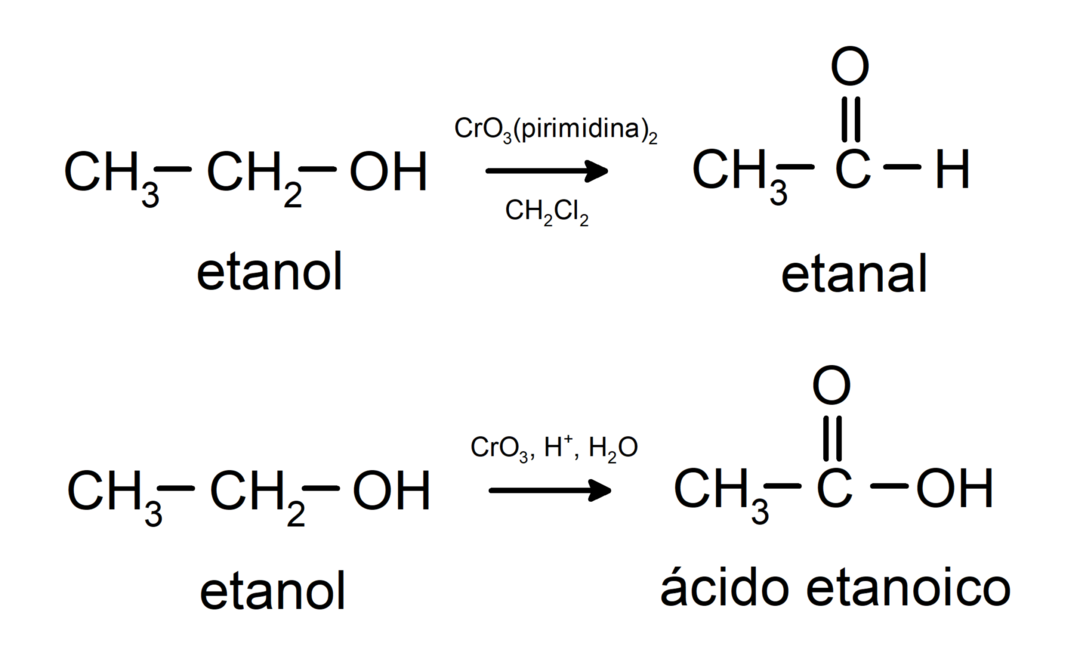
Oksidacija sekundarnega alkohola v keton.
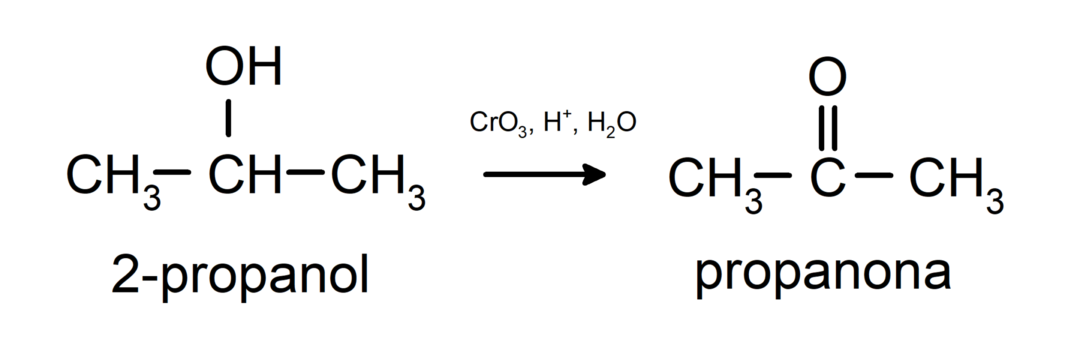
Terciarni alkoholi ne oksidirajo z običajnimi oksidanti. Z zelo močnimi oksidanti jih lahko pretvorimo v alkene, ki jih nato oksidiramo.
Alkoholi, ki imajo dve hidroksilni skupini na sosednjih ogljikovih atomih, se oksidirajo s svinčevim tetraacetatom, da nastanejo dva ketona.
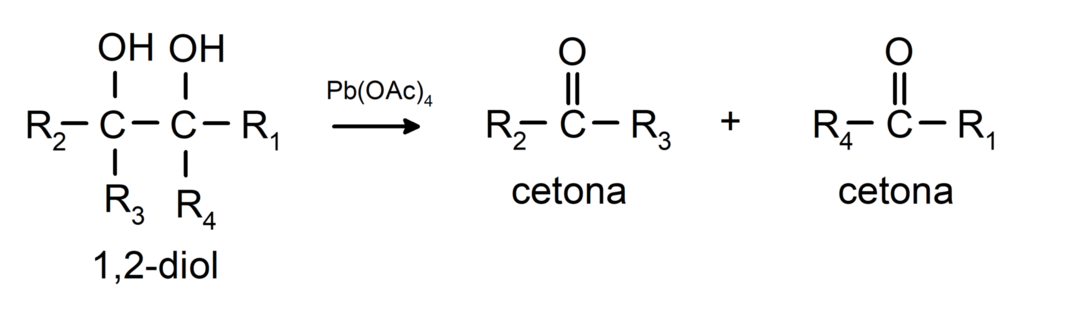
- Alkoholi so podvrženi reakcijam dehidrogenacije. Te reakcije potekajo samo s primarnimi in sekundarnimi alkoholi, ki ob izpostavljenosti visokim temperaturam v prisotnosti katalizatorjev sproščajo vodik.
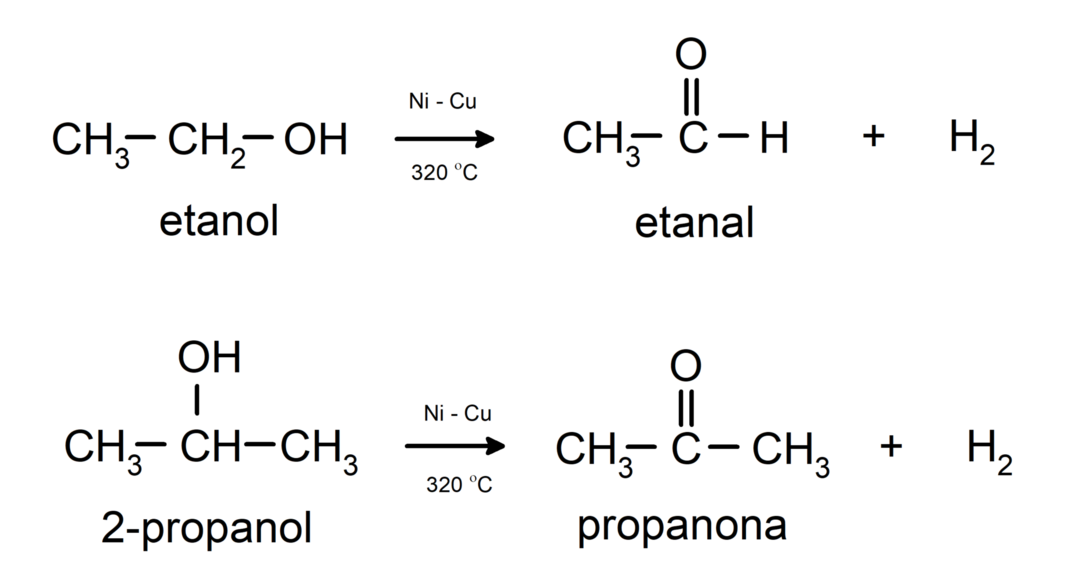
- Alkoholi so podvrženi reakcijam dehidracije. Alkoholi dehidrirajo, da nastanejo ustrezni alkeni. Ta reakcija poteka v prisotnosti kisline in vmesnih temperatur.
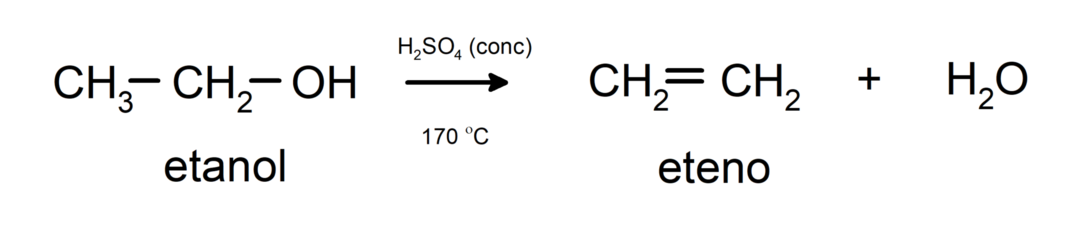
Alkoholna nomenklatura
V skladu z nomenklaturo, ki jo je določil IUPAC (Mednarodna zveza za čisto in uporabno kemijo), so alkoholi poimenovani po naslednjih pravilih:
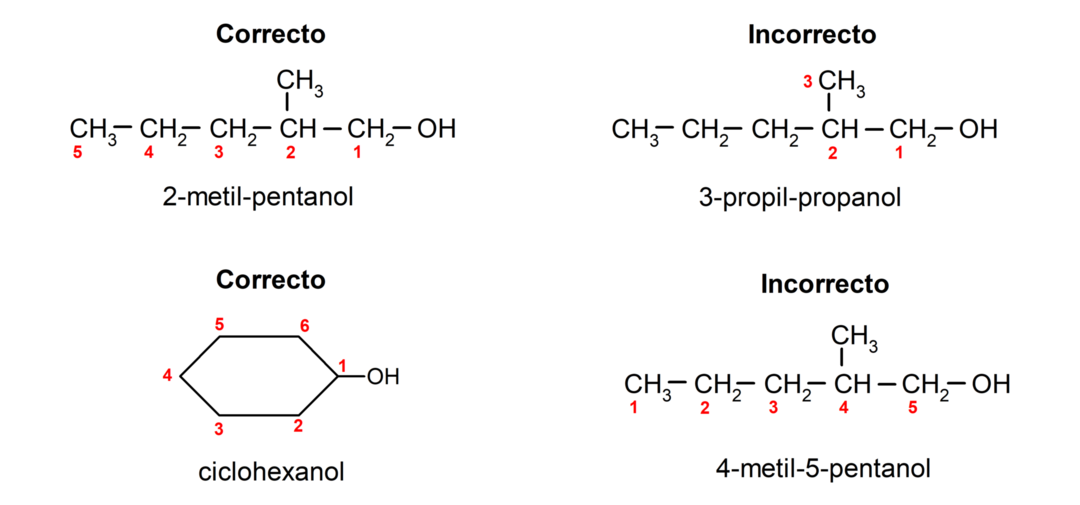
- Položaj hidroksilne skupine je izbran ob upoštevanju, da zavzema najmanjše možno število v ogljikovi verigi. Če je struktura alkohola ciklična, se upošteva položaj 1 na ogljiku, ki ima vezano hidroksilno skupino, in se za njegovo poimenovanje uporablja predpona ciklo-.
- Ime alkohola je napisano s predponami, ki označujejo število atomov v ogljikovi verigi, poleg tega pa je dodana pripona -ol.
- Če ima struktura alkohola veje, je za glavno ogljikovo verigo izbrana najdaljša veriga, ki vsebuje tudi hidroksilno skupino.
Po tradicionalni nomenklaturi se alkoholi poimenujejo tako, da se napiše beseda "alkohol" in nato napiše ime alkohola. alkan, ki ustreza ogljikovi verigi, vendar namesto končnice -an alkana, -ilno.
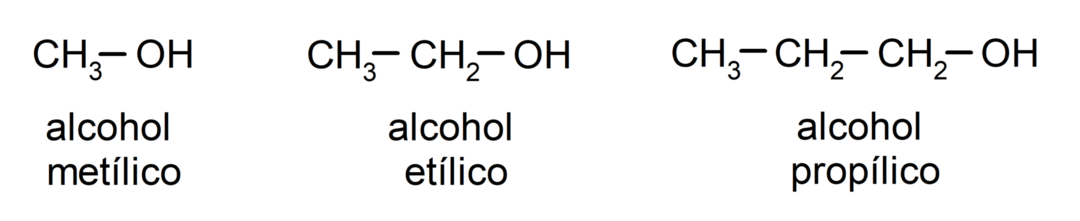
Primeri alkoholov
- metanol
- etanol
- 1-propanol
- 2-propanol
- 1-butanol
- 3-etilheksan-2-ol
- glicerol
- fenol
- 2-metil-2-butanol
- 1,2-etandiol
- 1,5-heptadien-3-ol
- 3-metil-2-butanol
- benzilmetanol
- 3-pentanol
- 2-metilfenol
- 1,2-dihidroksifenol
- cikloheaknol
- 1-feniletanol


Uporaba alkoholnih pijač
Najpogostejše uporabe alkohola so:
- Uporabljajo se kot razkužila in antiseptiki, saj nekaterim ustavijo rast mikroorganizmi ali jih uničiti. V ta namen se najpogosteje uporabljata etanol in izopropilni alkohol.
- Uporabljajo se pri sintezi različnih kemične spojine. Metanol se na primer uporablja za pridobivanje metanala (formaldehida).
- Uporabljajo se za proizvodnjo antifriza. Metanol je eden najpogosteje uporabljenih za ta namen.
- Uporabljajo se kot topila v farmacevtski industriji. Etanol je eden najbolj uporabljenih v tem smislu.
- Uporabljajo se kot topila za lake, barvila in črnila. V ta namen se pogosto uporablja metanol.
- Uporabljajo se kot gorivo in obstaja pomembna težnja po delni zamenjavi uporabe fosilna goriva z uporabo goriva bioetanola.
- Uporabljajo se za izdelavo smol. V tem smislu se uporablja fenol.
Nevarnosti uživanja alkohola
Čeprav je uživanje alkohola danes družbeno sprejemljivo, zloraba te snovi povzroča odvisnost in zasvojenost.
Etanol je alkohol, prisoten v alkoholnih pijačah, ki ob prekomernem uživanju vpliva kognitivne sposobnosti in lahko povzroči bolezni srca in ožilja, cirozo jeter in rak.
Nadalje, ko je dosežena stopnja alkoholne opitosti, to je stanje pijanosti, če je odmerek alkohola previsoko, lahko pride do alkoholne kome, kar lahko povzroči paralizo dihanja in celo smrt. smrt.
Reference
- T. TO. Geissman. (1974) »Načela organske kemije«, druga izdaja. Uredništvo Reverté, S.A. ISBN: 8429171800
- Ahumada-Cortez, J. G., Gámez-Medina, M. E. in Valdez-Montero, C. (2017). Uživanje alkohola kot javnozdravstveni problem. Ra Ximhai, 13(2), 13-24.
- Morrison, R. T. in Boyd, R. n. (1998). Organska kemija. Pearson izobraževanje.
- Weininger, S. J. in Stermitz, F. R. (1988). Organska kemija. Obrnil sem se.
Sledi z:
- Etilni alkohol
- Goriva
- organska kemija
