30 primerov binarne prodaje
Primeri / / November 09, 2023
The binarne soli (nevtralne soli) nastanejo, ko se kovina in nekovina združita. so kemične spojine sestavljen samo iz dveh kemični elementi. Na primer: natrijev klorid (NaCl) in kalijev bromid (KBr).
- Poglej tudi: Kovine in nekovine
Primeri binarnih soli
- Natrijev klorid (NaCl)
- Železov(II) klorid (FeCl2)
- Železov (III) klorid (FeCl3)
- Kobaltov(II) sulfid (CoS)
- Kobaltov (III) sulfid (Co2ja3)
- Svinčev (II) sulfid (PbS)
- Svinčev (IV) sulfid (PbS2)
- Kalcijev klorid (CaCl2)
- Natrijev fluorid (NaF)
- Litijev klorid (LiCl)
- Stroncijev klorid (SrCl2)
- Barijev klorid (BaCl2)
- Aluminijev klorid (AlCl3)
- Magnezijev sulfid (MgS)
- Rubidijev klorid (RbCl)
- Kalcijev bromid (CaBr2)
- Kalijev sulfid (K2S)
- Magnezijev bromid (MgBr2)
- Cinkov sulfid (Zn2S)
- Litijev bromid (LiBr)
- Nikljev klorid (NiCl2)
- Uranov (III) klorid (UCl3)
- Srebrov bromid (AgBr)
- Srebrov jodid (AgI)
- Kalijev bromid (KBr)
Nomenklatura binarnih soli
Po tradicionalni nomenklaturi se binarne soli imenujejo tako, da se ime nekovinskega elementa napiše s končnico -ide. Po drugi strani pa je ime kovinskega elementa zapisano glede na njegovo oksidacijsko stanje:
- Za najnižjo stopnjo oksidacije se piše s končnico -oso. Na primer: železov klorid (FeCl2), kjer ima železo oksidacijsko stopnjo 2+.
- Za najvišjo stopnjo oksidacije se piše s končnico -ico. Na primer: železov klorid (FeCl3), kjer ima železo oksidacijsko stopnjo 3+.
Po sistematični nomenklaturi se binarne soli imenujejo tako, da se ime nekovinskega elementa zapiše s predpono, ki označuje količino atomi tega elementa v spojini. Poleg tega je končnica -uro postavljena v ime nekovinskega elementa. Nato je postavljeno ime kovinskega elementa. Na primer: magnezijev diklorid (MgCl2) in železov triklorid (FeCl3).
Po Stockovi nomenklaturi se binarne soli imenujejo tako, da se ime nekovinskega elementa napiše s končnico -ide. Nato se doda ime kovinskega elementa, ki mu sledi njegovo oksidacijsko stanje, napisano z rimskimi številkami in v oklepaju. Na primer: železov(II) klorid (FeCl2) in kobaltov(III) sulfid (Co2ja3).
Uporaba binarnih soli
- Uporabljajo se kot hladilna sredstva v prehrambeni in farmacevtski industriji. Na primer: kalcijev klorid (CaCl2).
- Uporabljajo se za zaščito kovinskih površin pred korozijo. Na primer: natrijev fluorid (NaF).
- Uporabljajo se za uravnavanje vlage v papirni in gradbeni industriji. Na primer: kalcijev klorid (CaCl2).
- Uporabljajo se v steklarski industriji za odstranjevanje nečistoč. Na primer: silicijev tetraklorid (SiCl4).
- Uporabljajo se kot sestavine za kuhanje. Na primer: natrijev klorid (NaCl).
Fizikalne lastnosti binarnih soli
- Imajo visoka tališča, ker so sestavljeni iz ionske vezi.
- Ko so raztopljeni ali stopljeni, prevajajo električni tok.
- Najpogostejše soli imajo nizko trdoto.
- Niso stisljive.
- Večina se lahko raztopi v vodi.
Kako se pridobivajo binarne soli?
Binarne soli je mogoče pridobiti z nekaterimi od naslednjih kemičnih reakcij:
Reakcija med kovino in nekovino. Na primer: reakcija med natrijem (Na) in dikloridom (Cl2) proizvaja natrijev klorid (NaCl).
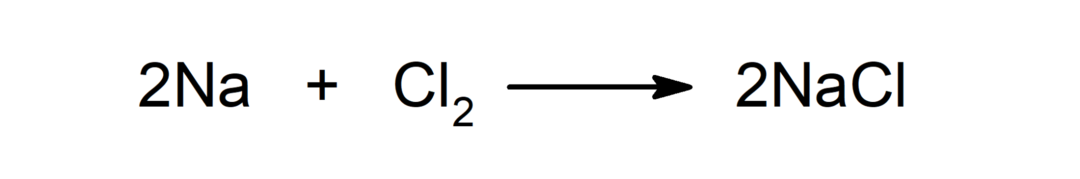
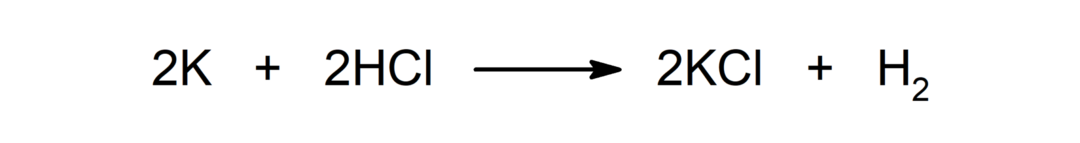
Reakcija med kovino in kislino. Na primer: Pri reakciji med kalijem (K) in klorovodikovo kislino (HCl) nastaneta kalijev klorid (KCl) in dihidrogen (H2).
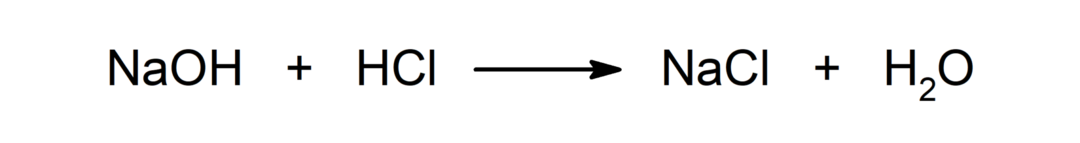
Reakcija med kislino in bazo. Na primer: Pri reakciji med klorovodikovo kislino (HCl) in natrijevim hidroksidom (NaOH) nastane natrijev klorid (NaCl) in voda (H2ALI).
Sledi z:
- oksisoli
- nevtralne soli
- kislinske soli
Reference
- Cerón Villalba, A., Novoa Ramírez, C. S. in Alpizar Juárez, E. (2020). Nomenklaturni video 1: binarne soli in kemijske reakcije.
- Acurio Arias, M. V. in Delgado Méndez, M. IN. (2022). Učni vodnik za "binarne spojine" v srednješolski kemiji na izobraževalni enoti "Herlinda Toral" v obliki iger (diplomsko delo, NŠU).
- Cabrera, M. J. H. (2005). Študij iz prvih principov elektronskih in strukturnih lastnosti binarnih in ternarnih spojin (Doktorska disertacija, Univerza La Laguna).