Primer kovinske vezi
Kemija / / July 04, 2021
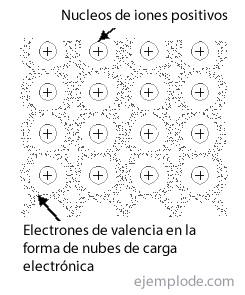
The Kovinska povezava je način, kako se atomi kovine uspejo srečati v kristalna struktura, stabilno, z uporabo oblaki svojih elektronovin ne glede na ekskluzivnost ionskih ali kovalentnih vezi, da se manifestirajo kot čiste snovi. Je imenovan Mreža na skupino ali razporeditev kovinskih povezav.
Večina kovin kristalizira v treh vrstah aranžmajev: Kubična omrežja, osredotočena na telo, Obrazno usmerjena kubična omrežja Y. Kompaktna šesterokotna omrežja.
V v središču telesa, vsak atom kovine je obdan s 14 sosedi, v drugih pa preostali dve do 12.. Če se poskušate spoprijeti z vezavo takšnih struktur, boste takoj našli težavo z elektronsko pomanjkljivostjo. Tako je treba v primeru litija z enim samim valentnim elektronom in 14 bližnjimi sosedi razložiti, kako je ta element obdan s tako velikim številom atomov, toda tvori kristal, ki je dovolj stabilen, da ima tališče 186 ° C. Enako se zgodi z drugimi kovinami.
Švicarski fizik Felix bloch leta 1928 je predlagal kvantno mehansko teorijo, da bi razložil vez atomov v kovinskih kristalih. V tem
Teorija pasov vsi elektroni, prisotni v atomu pri popolnoma napolnjenih nivojih energije, se v bistvu štejejo za nahaja, to je vezan na atome, s katerimi so povezani. Po drugi strani pa se upoštevajo valenčni elektroni v neizpolnjenih nivojih energije prostin se premikajo v potencialnem polju, ki se razteza na vse atome, prisotne v kristalu.The atomske orbitale teh prostih elektronov v atomu lahko prekrivajo s tistimi drugih, ki izvirajo delocirane molekularne orbitale ki tvorijo vez med vsemi prisotnimi atomi in so znani po imenu Orbitale prevodnosti.
The ravni energije elektronov v izoliranih atomih so diskretno in na splošno dobro razporejeni. Toda prisotnost drugih atomov v kristalu vpliva na te ravni s pretvorbo vsake ravni v a ravni pas katerega število je enako številu atomov, prisotnih v strukturni celoti. Če je to število veliko, predstavlja vsaka izolirana raven praktično a neprekinjen pas. Tudi kadar je prostor med prvotnimi nivoji in med atomi v kovini velik, potem pasovi, ki izvirajo iz zgodnjih elektronskih nivojev, so ločeni drug od drugega za energetske vrzeli precejšen. Ko so ravni in razdalje majhne, so pasovi majhni križati in prekrivati vsak.
Ta teorija vsebuje naslednji opis elektronske strukture dane kovine. A trdna kovina se šteje, da ima elektronski pasovi ločeni drug od drugega z energetske vrzeli. Poleg tega so ti pasovi včasih popolnoma napolnjeni z lokaliziranimi elektroni ali pa so delno napolnjeni s prostimi elektroni, katerih molekularne orbitale segajo do vseh atomov v kristalu.