Primer kovalentne vezi
Kemija / / July 04, 2021
The Kovalentna vez je tista, v kateri dva atoma se združita tako, da delita svoja elektrona, da nadaljuje z dopolnjevanjem svojih pravil Okteta.
Zgodovina kovalentne vezi
V začetku 20. stoletja so kemiki začeli razumeti, kako in zakaj nastajajo molekule. Prvi večji preboj se je zgodil s predlogom Gilbert lewis o čem tvorba kemične vezi pomeni, da atomi delijo elektrone. Lewis je tvorbo kemične vezi v vodiku opisal kot:
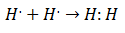
Ta vrsta elektronskega seznanjanja je primer kovalentne vezi, vez v kateri dva elektrona si delita dva atoma. The Kovalentne spojine Oni so to vsebujejo samo kovalentne vezi.
Elektroni v kovalentni vezi
Za poenostavitev skupni elektronski par je pogosto predstavljen kot ena vrstica povezovanje simbolov elementov. Tako je kovalentna vez molekule vodika zapisana kot H-H.
V kovalentni vezi je vsak elektron skupnega para privlačijo jedri obeh atomov. Ta privlačnost drži oba atoma v molekuli H skupaj.2 in je odgovoren za tvorbo kovalentnih vezi v drugih molekulah.
V kovalentnih vezah med atomi več elektronov
sodelujejo samo valenčni elektroni, ki so najbolj zunanji, v najgloblji orbiti. Od enega do treh jih bo sodelovalo v sindikatu.Pokličejo se drugi elektroni, ki ne sodelujejo v vezi Nelepilni elektroni, ali če jih organiziramo v parih, Brezplačni pari. Se pravi, pari Valencia Electrons ne sodelujejo pri oblikovanju kovalentnih obveznic.
Zastopanje kovalentnih obveznic
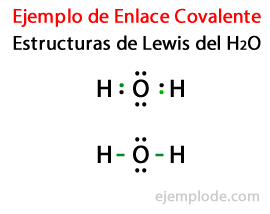
Strukture, s katerimi so zastopane kovalentne spojine, kot je H2 in F2 so znani kot Lewisove strukture. Lewisova struktura je a predstavitev kovalentne vezi, kjer je par skupnih elektronov označeni s črtami ali kot par točk med dvema atomoma, in skupni prosti pari so označeni kot par točk na posameznih atomih. V Lewisovi strukturi so prikazani samo valentni elektroni in ne notranji.
Upoštevajoč Lewisovo strukturo za molekulo vode H2Ali pa so vsi valenčni elektroni atomov vodika in kisika najprej označeni s pikami.
V drugem primeru je povezava označena s črto. In prosti pari, ki bodo obstajali le v kisiku, s točkami.
Pravilo okteta
Tvorba teh molekul, kot pri vodi H2Ali ponazorite klic Pravilo okteta, ki ga predlaga Lewis: Atom, ki ni vodik, ponavadi tvori vezi, dokler se ne obda osem valentnih elektronovSe pravi, kovalentna vez nastane, kadar za vsak posamezen atom ni dovolj elektronov, da bi dokončal svoj oktet.
Z delitvijo elektronov v kovalentni vezi, vsak atom zaključi svoj oktet. Za vodik je zahteva, da pridobite elektronsko konfiguracijo helija, ki naj bi imel skupaj dva elektrona.
Pravilo okteta deluje predvsem za elemente drugega obdobja ali vrstice periodnega sistema. Ti elementi imajo podnivoja, v katerih je lahko skupaj osem elektronov.
Ko atom teh elementov tvori kovalentno spojino, pridobi elektronsko konfiguracijo neonskega žlahtnega plina in si deli elektrone z drugimi atomi v isti spojini.
Vrste kovalentnih obveznic
Atomi lahko tvorijo različne vrste kovalentnih vezi: Samski, dvojice ali trojke.
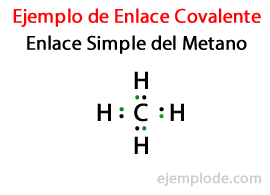
V Preprosta povezava, dva atoma sta združena s pomočjo Par elektronov. Pojavljajo se v veliki večini kovalentnih spojin in je najosnovnejša oblika te vezi.
V mnogih spojinah Dvojne povezave, to je, kadar si delita dva atoma Dva para elektronov. Če si dva atoma delita dva para elektronov, se kovalentna vez imenuje dvojna vez. Te vezi najdemo v molekulah, kot je ogljikov dioksid (CO2) in etilen (C2H4).

A Trojna povezava nastane, ko si delita dva atoma Trije pari elektronov, kot v molekuli dušika N.2, molekulo acetilena C.2H2.

Več vezi so krajše od enojnih kovalentnih vezi. The Dolžina povezave je opredeljen kot razdalja med jedrom dveh združenih atomov s kovalentno vezjo v molekuli.
Razlike med kovalentnimi in ionskimi spojinami
Ionske in kovalentne spojine imajo izrazite razlike v svojih splošnih fizikalnih lastnostih, ker so njihove vezi različne narave.
V Kovalentne spojine obstajajo dve vrsti privlačnih sil; eden izmed njih je tisti, ki drži atome molekule skupaj. Kvantitativno merilo te privlačnosti je vezavna energija. Druga sila privlačnosti deluje med celotnimi molekulami in se imenuje Medmolekularna sila. Ker so medmolekularne sile običajno šibkejše od sil, ki držijo atome molekule skupaj, se molekule kovalentne spojine vežejo z manjšo silo.
V zaporedju, kovalentne spojine so skoraj vedno plini, tekočine ali trdne snovi z nizkim tališčemn. Po drugi strani pa elektrostatične sile, ki držijo ione skupaj v ionski spojini so običajno zelo močni, tako da so ionske spojine pri sobni temperaturi trdne in imajo visoka tališča. Številne ionske spojine so topne v vodi in njihove vodne raztopine prevajajo elektriko, ker so te spojine močni elektroliti.
Večino od kovalentne spojine v vodi niso topne, in če se raztopijo, njegove vodne raztopine kot vedno ne prevajajo električne energije ker so te spojine neelektroliti. Staljene ionske spojine prevajajo elektriko, ker vsebujejo katione in anione, ki se prosto gibljejo; tekoče ali staljene kovalentne spojine ne prevajajo električne energije, ker ni prisotnih ionov.
Primeri kovalentno vezanih spojin
- Acetilen C2H2
- Metan CH4
- Etan C2H6
- Propan C3H8
- Butan C4H10
- Benzen C6H6
- Toluen C7H8
- Metilni alkohol CH3Oh
- Etilni alkohol C.2H5Oh
- Propilni alkohol C.3H7Oh
- Metil eter CH3OCH3
- Metil etil eter C2H5OCH3
- Etil eter C2H5OC2H5
- Mravljična kislina HCOOH
- Ocetna kislina CH3COOH
- Propionska kislina C2H5COOH
- Maslena kislina C3H7COOH
- Ogljikov dioksid CO2
- Ogljikov monoksid CO
- Molekularni dušik N2
- Molekularni vodik H2


