Primer kemijskih osnov
Kemija / / July 04, 2021
V splošni kemiji, Baze so kategorija kemikalij ki izpolnjujejo več funkcij:
-Reagirajte s kislinami v nevtralizaciji, ki proizvaja sol in vodo.
-Regulirajte potencial vodika, pH, zvišajo njegovo vrednost, če jih vlijemo v sredino, kjer najdemo reakcijo.
-Zaženi kot Kemični reagenti za veliko število reakcij.
Osnove so lahko različne vrste, obe Anorganska kemija od Organska kemija, Kot Hidroksidi, Amini in Alkoholi, na primer.
Za opredelitev obnašanja baz se uporabljajo tri glavne kislinsko-bazične teorije: Arrheniusova, Brönsted-Lowryjeva in Lewisova.
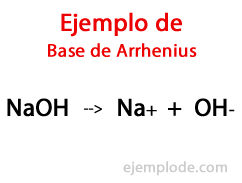
Osnove po Arrheniusu
Po navedbah švedskega kemika Svante Arrhenius, Osnove so tiste kemične snovi, ki zagotavljajo hidroksilne ione (OH-) v reakcijski medij, zlasti če gre za vodno raztopino. Tako bodo z razpoložljivimi hidroksilnimi ioni prisotni a Alkalni pH, to je z vrednostjo, večjo od 7, in do 14 odvisno od tega, koliko baze je prisotna v času merjenja.
To je ena najpreprostejših in najbolj praktičnih teorij, ki se uporablja, saj nima zapletov za razlikovanje snovi, ki sodelujejo v reakciji. Dobro je znano, katera je kislina in katera baza.
V tej teoriji obstajajo nesporno anorganski hidroksidi, kot sta natrijev hidroksid (NaOH) in kalijev hidroksid (KOH).
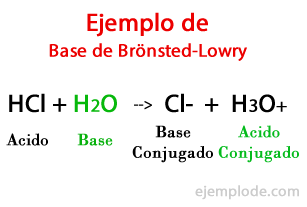
Osnove po Brönsted-Lowryju
V skladu s teorijo, ki so jo oblikovali Danski Johannes Brönsted in britanski Thomas Martin Lowry, Base je kemična vrsta sposoben sprejeti protone, ki jih bo dala druga, kislina med kemično reakcijo. Proton je na splošno povezan s pozitivnim nabojem, ki ga zaznamuje, zato ga lahko spet povežemo z vodikovimi ioni (H +).
Ko pride do izmenjave v kemični reakciji, proizvodi se imenujejo: "konjugirana kislinska baza" in "konjugirana osnovna kislina"na osnovi reaktantov, ki so jih tvorili.
Za to teorijo je Amoniak (NH3) je najbolj reprezentativen primer. Za Brönsteda in Lowryja so snovi, ki lahko zadržijo vodikove ione (H +), osnove. V tem primeru bo amoniak z obnašanjem kot baze pridobil vodik v svoji strukturi in se utrdil kot amonijev ion (NH4+), s presežkom pozitivnega naboja vodika. Amonij je konjugirana kislina amoniaka.
Amini, organske spojine, pridobljene iz amoniaka (NH3), kot je metil amin (CH3NH2), ko so v raztopini, se obnašajo kot baze in so sposobni sprejemati pozitivne naboje v svoji strukturi, bodisi iz vodika ali karbokacije.
Karbokacija je organski ion, ki nastane kot ogljikovodikova veriga, ki v odsotnosti negativnega iona, ki Lahko je hidroksil (OH-) ali halogen (Cl-, Br-), ponavadi se veže na mesto, ki ga lahko sprejme, kar bo Osnova.
Osnove po Lewisu
Ameriški znanstvenik Gilbert lewis je v svoji teoriji kislinsko-baznih snovi opozoril, da so baze so tiste snovi, ki lahko prispevajo svoje pare prostih elektronov, da drugi dopolni svoj oktet.
Ta kislinsko-bazična teorija je dopolnilo k ponovni potrditvi veljavnosti svojega pravila okteta, v katerem opisuje, kako atomi dosežejo stabilnost z doseganjem števila osmih elektronov v zadnji lupini z uporabo vezi Kovalentno
Hydroxyl ion je dober primer Lewisove baze. Ima par prostih elektronov, na katere lahko pride vodikov ion, ki nima elektronov. Nastala bo molekula vode. Tako bo nastal oktet za kisik molekule, vodiki, ki so manjši atomi, pa bodo imeli svoj par elektronov, ki jih bo naredil stabilne.

Uporabe pomembnih podlag
The Natrijev hidroksid NaOH Običajno se uporablja v vodni raztopini za čiščenje strjene masti v gospodinjskih in industrijskih pečeh, ki jo učinkovito raztopi. Uporablja se tudi v koncentrirani raztopini, ko pride do nepredvidenega razlitja kisle snovi, da jo nevtralizira.
The Magnezijev hidroksid Mg (OH)2 Uporablja se v raztopini, imenovani "magnezijevo mleko", za reševanje zgage in jo nevtralizira. Prodaja se v lekarnah.
The Kalijev hidroksid KOH Uporablja se kot reagent za postopke umiljenja, ki maščobe pretvarja v milo.
The Amoniak NH3 V plinasti obliki se uporablja kot industrijsko hladilno sredstvo, zlasti pri ledenikih. Uporaba je zelo nevarna, saj je vdihavanje koncentracije 5 miligramov na liter v zraku lahko usodno.
Primeri kemijskih osnov
Voda H2ALI
Amoniak NH3
Natrijev hidroksid NaOH
Kalijev hidroksid KOH
Magnezijev hidroksid Mg (OH)2
Kalcijev hidroksid Ca (OH)2
Aluminijev hidroksid Al (OH)3
Amonijev hidroksid NH4Oh
Fe (OH) železov hidroksid2
Ferov hidroksid Fe (OH)3
Hidroksil-ion (OH-)
Kloridni ion (Cl-)
Bromid-ion (Br-)