Vrste kemičnih vezi
Kemija / / July 04, 2021
Ko dva ali več atomov tvori molekulo, se združijo s pomočjo a stičišče med elektroni zadnjih površin, najbolj površna. Ta zveza se imenuje Kemična vez. Da lahko kemična vez nastane, morajo imeti atomi svoje nepopolni oktet, to je manj kot osem elektronov v zadnji lupini, kar je število, ki jim bo dalo kemijsko stabilnost.
Obstajajo tri vrste kemičnih vezi:
- Jonske vezi
- Kovalentne vezi
- Kovinske povezave
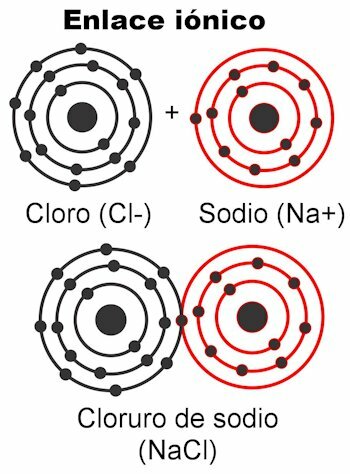
Jonske vezi
Jonske vezi so tiste, v katerih so valentni elektroni privlačijo elektrostatične sile. Atomi, ki imajo 1 do 4 valenčne elektrone, jih lahko oddajo v vez; To mu daje pozitiven naboj, ker bi se znebil negativnega naboja. Po drugi strani pa bodo atomi, ki imajo od 5 do 7 valenčnih elektronov, sposobni sprejeti potrebne, da dosežejo 8.
To jim da negativni naboj, ker poberejo elektrone, ki so negativni. Dejstvo, da je mogoče zajeti ali oddati elektrone daje atomom električni naboj. Po Coulombovem zakonu sta naboja nastala na obeh atomih drug drugega bodo privlačili s silo, ki je zgoraj omenjena elektrostatika. Negativni naboji privlačijo pozitivne naboje in obratno.
Privlačijo se nasprotni naboji. Ko jih ta sila veže, molekula nastane.Ionske vezi se večinoma pojavljajo med kovinskimi in nekovinskimi atomi. Kovine se predajo svojim elektronom in vedno nosijo pozitiven naboj in sodelujejo kot kation (+). Nekovine so elektronski receptorji in običajno nosijo negativni naboj, sodelujejo kot anioni (-), zgodi pa se tudi, da nosijo pozitiven naboj, in sicer takrat, ko tvorijo skupine nabitih atomov poklical radikalikot amonijev NH4+, karbonat CO3-2, fosfat PO4-3.
Med kemičnimi spojinami, ki jih tvorijo ionske vezi, so:
- Binarne soli
- Oxisales
Ko se te snovi raztopijo v vodi ločijo se, in sicer ločijo na svoje električne naboje in ti se razpršijo v vodi skupaj z vodikovimi ioni H+ in hidroksil (OH-), ki tvorijo vodo. Zmes, ki nastane, je raztopina, imenovana elektrolit.
- Nadaljujte z branjem: Jonska vez
Kovalentne vezi
Kovalentne vezi so tiste, v katerih se delijo elektroni ne da bi jih ločili od atoma, to je brez tvorbe električnih nabojev. Atomi se držijo skupaj zaradi bližine in uporabljajo silo, s katero jedro privlači elektrone. Ko se vez oblikuje, dve ali več jeder atomov na koncu privabljata skupne elektrone in s tem izpolnjujeta pravilo okteta in molekulo stabilno.
Obstaja več oblik kovalentne vezi in so:
- Kovalentna vez
- Koordinatna kovalentna vez
- Polarna kovalentna vez
- Nepolarna kovalentna vez
The kovalentna vez Tako je, kot je opisano na začetku. Sodelujoči atomi si delijo elektrone, tako da imajo vsi svoj popoln oktet. Tu ni električnih nabojev, ker se elektroni ne izločijo, temveč se delijo.
V koordinatna kovalentna vez samo en atom prispeva vse elektrone, potrebne za vez. Drugi atom se preprosto poveže in te elektrone vzame za svoje. Molekula nastane tako. To je na primer žveplova kislina H2SW4 v katerem žveplo deli dva para elektronov z atomi kisika.
V polarna kovalentna vez, sile med atomi so nagnjene na eno stran molekule. To kadar obstajajo različne vrste atomov v molekuli. Ta sila se meri v enotah Debye in večja kot je njena vrednost na eni strani molekule, bolj polarna bo. To pomeni, da so v strukturi oblikovani polovi, zato imajo tudi to ime. Njegove sile so asimetrične.
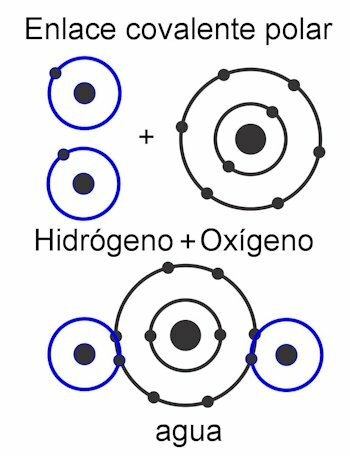
V nepolarna kovalentna vez, so sile med atomi enakomerne po celotni molekuli in zato v njeni strukturi ne nastanejo polovi. Deluje kot ena enota in zato je zelo težko, skoraj nemogoče, razdeliti njegove obremenitve. Zaradi tega je netopen v vodi. To je primer spojin, kot so alkani, ki imajo enake sile v celotni molekuli. Njegove sile so simetrične.

- Nadaljujte z branjem: Kovalentna vez
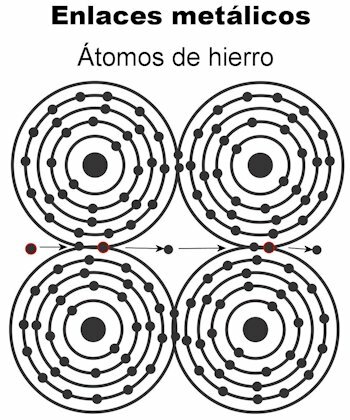
Kovinska vez
Atomi kovine se držijo skupaj s pomočjo kovinskih vezi. Pri tej vrsti vezi elektrone vseh atomov privlači, da tvorijo kristalno mrežo, ki ostane trdna. Vezi kristalne rešetke imajo vse elektrone razpršene in urejen za prenos električnega toka in toplote ko se jim prenaša. V prehodnih kovinah je ta struktura kovinskih vezi bolj izjemna, ker so njihovi atomi večji.
Primeri ionske vezi
Nekatere snovi, ki imajo ionske vezi, so:
- Natrijev klorid NaCl. Njeni ioni so Na+ in Cl-.
- Kalijev klorid KCl. Njeni ioni so K+ in Cl-.
- Kalcijev klorid CaCl2. Njeni ioni so Ca+2 in Cl-.
- Magnezijev klorid MgCl2. Njegovi ioni so Mg+2 in Cl-.
- Stroncijev klorid SrCl2. Njeni ioni so Sr+2 in Cl-.
- Barijev klorid BaCl2. Njeni ioni so Ba+2 in Cl-.
- Aluminijev klorid AlCl3. Njeni ioni so Al+3 in Cl-.
- Na natrijev sulfat2SW4. Njeni ioni so Na+ In tako4-2.
- Kalijev K sulfat2SW4. Njeni ioni so K+ In tako4-2.
- Kalcijev sulfat CaSO4. Njeni ioni so Ca+2 In tako4-2.
- Kalcijev sulfat MgSO4. Njegovi ioni so Mg+2 In tako4-2.
- Stroncijev sulfat SrSO4. Njeni ioni so Sr+2 In tako4-2.
- Barijev sulfat BaSO4. Njeni ioni so Ba+2 In tako4-2.
- Na natrijev fosfat3PO4. Njeni ioni so Na+ in PO4-3.
- Kalijev K fosfat3PO4. Njeni ioni so K+ in PO4-3.
- Magnezijev fosfat Mg3(PO4)2. Njegovi ioni so Mg+2 in PO4-3.
- Kalcijev fosfat Ca3(PO4)2. Njeni ioni so Ca+2 in PO4-3.
- Aluminijev fosfat AlPO4. Njeni ioni so Al+3 in PO4-3.
- Železov fosfat Fe3(PO4)2. Njeni ioni so Fe+2 in PO4-3.
- Železov fosfat FePO4. Njeni ioni so Fe+3 in PO4-3.
Primeri kovalentne vezi
Nekatere snovi, ki predstavljajo kovalentne vezi, so:
- Metan CH4.
- Etan C2H6.
- Propan C3H8.
- Butan C4H10.
- Pentan C5H12.
- Heksan C6H14.
- Heptan C7H16.
- Oktan C8H18.
- Propilen CH2= CH2–CH3.
- Acetilen C2H2.
- Metilni alkohol CH3
- Etilni alkohol C2H5
- Propilni alkohol C3H7
- Izopropilni alkohol CH3CH (OH) CH3.
- 2-propanon ali aceton CH3Avto3.
- Formaldehid HCHO.
- Acetaldehid CH3
- Propionaldehid CH3CH2
- Butiraldehid CH3CH2CH2
- Mravljična kislina HCOOH.
Primeri kovinske vezi
Nekatere snovi, ki predstavljajo kovinsko vez, so:
- Cink Zn
- Kadmij Cd
- Baker Cu
- Srebrna ag
- Zlata Au
- Nikelj Ni
- Paladij Pd
- Platina Pt
- Cobalt Co
- Rodijev Rh
- Iridium Go
- Železo Fe
- Rutenij Ru
- Osmij Os
- Mangan Mn
- Krom Cr
- Molibden Mo
- Wolfram W
- Vanadij V
- Zrkonij Zr
Sledite z:
- Atomi
- Ion
- Kovine
- Brez kovin
- Alkani
- Rešitve
