100 примера хемијских елемената
Мисцелланеа / / November 13, 2021
Тхе хемијски елементи су врста материје која никаквим поступком или хемијска реакција могу се редуковати или разложити на друге једноставније елементе. Из тог разлога се може рећи да је елемент све материја маде би атоми исте и јединствене класе, односно атома који имају исти атомски број (једнак број протона), иако имају различиту атомску масу. На пример: сумпор, бор, хром, калај.
Прву дефиницију хемијског елемента увео је Лавоисиер ат Траите Елементаире де Цхимиегодине, 1789. Још у 18. веку, Лавоазје је поделио једноставне супстанце у четири групе:
Периодични систем елемената
Данас се познају 118 хемијских елемената. Сви су они окупљени, класификовани и организовани према многим њиховим својствима у графичкој шеми познатој као Периодични систем елемената, који је првобитно креирао руски хемичар Димитрија Мендељејева 1869. године. Периодични систем је састављен од 18 група (колона) и 7 периода (редова), у којима се налазе хемијски елементи.
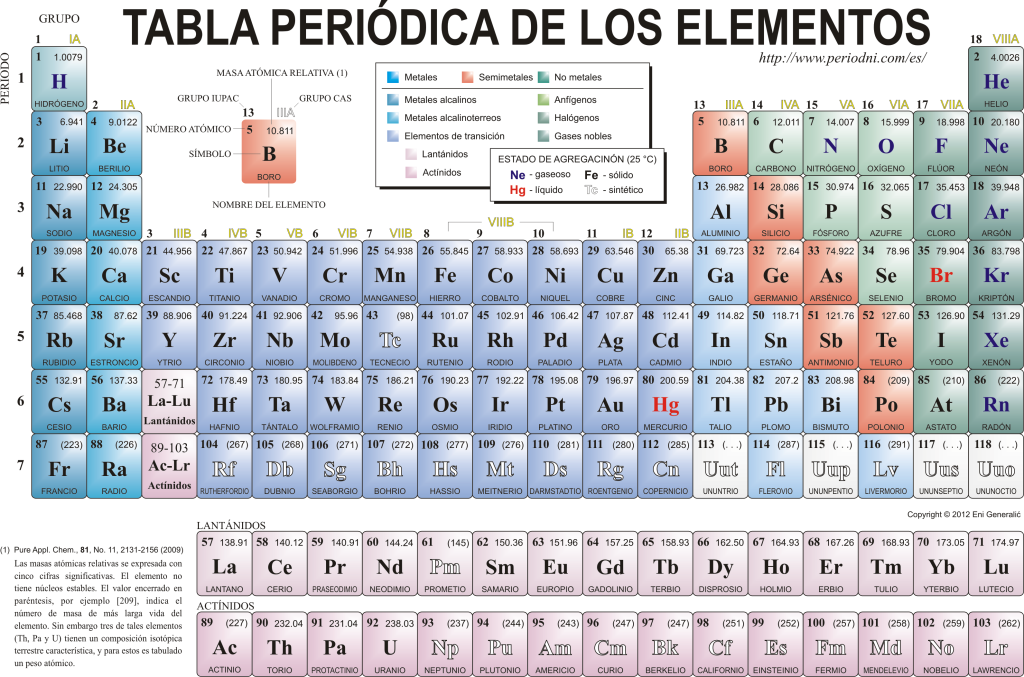
Тхе главне групе који се могу наћи у овој табели су:
Алкални метали (Група 1), земноалкални метали (Група 2), породица скандијума, која укључује земље и актиниде (Група 3), породица титанијума (Група 4), породица ванадијума (Група 5), породица хрома (Група 6), породица мангана (Група 7), породица гвожђа (Група 8), породица кобалта (Група 9), породица никла (група 10), породица бакра (група 11), породица цинка (група 12), елементи земље (група 13), карбонидни елементи, у овој групи су Угљеник, који чини основу живота на Земљи (Група 14), елементи који формирају азот (Група 15), амфигенетски елементи, укључује кисеоник, основни елемент за тхе дисање од жива бића (Група 16), халогени елементи (Група 17) и племенити гасови (Група 18).
Многи од ових елемената имају стабилних или радиоактивних изотопа, односно исти хемијски елемент, на пример водоник (Х), може имати неколико изотопа (1Х, 2Х, 3Х). То значи да сваки атом изотопа има исти број протона (што имплицира да припада истом хемијском елементу) и различит број неутрона.
Неки изотопи нису стабилни (радиоактивни), тј. распасти се у одређеном времену, емитујући одређене честице (неутроне, фотоне, алфа честице, између осталог) и генеришући друге стабилне или радиоактивне изотопе. Хемијски елементи имају својства као што је тачка кључање и то од фузију, електронегативност, густина и јонски радијус, између осталог. Ова својства су важна јер нам омогућавају да предвидимо његово понашање, реактивност итд.
Како су елементи представљени у периодном систему?
Сваки хемијски елемент је окарактерисан у Периодни систем користећи одређену симболику. На првом месту, у центру сваке кутије њен универзални симбол, који се састоји од једног или два слова (по конвенцији, ако постоје два слова, прво се пише великим, а следеће малим).
Изнад и лево се појављује малим словима су атомски број, који означава количину протона коју овај елемент има. Испод симбола елемента се појављује његово име, а изнад, са леве стране, његово име. атомска маса у односу. Поред тога, боја у којој је представљен симбол елемента означава његово стање агрегације (према репрезентацији која се користи у сваком периодичном систему).
Присутни различити елементи атомски радијуси променљиве и, како се број протона у језгру повећава, то је већа привлачност коју језгро врши на електроне, па радијус атома тежи да се смањи. Када је атомски радијус мали, електрони на крајњем нивоу облака су веома привучени језгром, тако да не одустају лако. Супротно се дешава са елементима са високим атомским радијусима: они лако одустају од својих спољашњих електрона.
Дакле, атомски радијус се повећава од врха до дна када пролазимо кроз групе периодног система и смањује се с лева на десно док пролазимо кроз њихове периоде.
Примери хемијских елемената
| Хемијски елемент | Симбол |
| Ацтиниум | Ац |
| Алуминијум | До |
| Америциум | САМ |
| Антимон | Сб |
| Аргон | Ар |
| Арсениц | Аце |
| Астат | Ат |
| Сумпор | С |
| Баријум | Ба |
| Берилијум | Буди |
| Беркелијум | Бк |
| бизмут | Би |
| Бохрио | Бх |
| Бор | Б |
| бром | Бр |
| Кадмијум | ЦД |
| Калцијум | АЦ |
| Калифорнија | Уп |
| Царбон | Ц |
| Церијум | ЕЦ |
| цезијум | Цс |
| Хлор | Цл |
| кобалт | Цо |
| Бакар | Цу |
| Хром | Цр |
| Цуриум | Центиметар |
| Дармстадио | Дс |
| Диспрозијум | Ди |
| Дубниум | Дб |
| Еинстеиниум | То је |
| Ербиум | Ер |
| Сцандиум | Сц |
| Калај | Сн |
| стронцијум | господин |
| Еуропиум | ЕУ |
| фермијум | Фм |
| Флуор | Ф |
| Утакмица | П |
| Франциус | о |
| Гадолинијум | Гд |
| галијум | Га |
| германијум | Ге |
| Хафнијум | Хф |
| Хассио | Хс |
| Хелијум | ја имам |
| Водоник | Х |
| Гвожђе | Фаитх |
| Холмијум | Хо |
| Индијанац | Ин |
| јод | И |
| Иридијум | Да иде |
| Иттербиум | Иб |
| Итријум | И |
| Криптон | Кр |
| Лантанум | Тхе |
| Лавренцио | Лр |
| литијум | Ли |
| лутецијум | пон |
| Магнезијум | Мг |
| манган | Мн |
| Меитнериус | Мт |
| Менделевиум | Доктор медицине |
| Меркур | ХГ |
| молибден | Мо |
| неодимијум | На |
| Неон | Не |
| Нептунијум | Нп |
| Ниобиум | Нб |
| Никл | Ни |
| Азот | Н |
| Нобелио | Не |
| Злато | Ау |
| Осмијум | ти |
| Кисеоник | ИЛИ |
| Паладијум | П.С |
| Сребро | Аг |
| Платинум | Пт |
| Олово | Пб |
| Плутонијум | Пу |
| Полонијум | По |
| Калијум | К |
| Прасеодимиум | Пр |
| Обећавам | После подне |
| Протактинијум | Па |
| Радио | Ра |
| Радон | Рн |
| ренијум | Ре |
| родијум | Рх |
| Рубидијум | Рб |
| Рутенијум | Ру |
| Рутхерфордио | Рф |
| Самаријум | Ие |
| Сеаборгио | Сг |
| Селен | Знам |
| Силицијум | да |
| натријум | На |
| талијум | Тл |
| Танталум | Та |
| тецхнетиум | Тц |
| Телуријум | Чај |
| тербијум | Тб |
| Титанијум | ти |
| торијум | Тх |
| Тхулиум | Тм |
| Коперник | Цн |
| Ливерморио | Лв |
| Роентгенио | Рг |
| Унуноцтиум | Ууо |
| Унунпентиум | Ууп |
| Флеровио | Фл |
| Унунсептио | Уус |
| Унунтријум | Уут |
| Уранијум | ИЛИ |
| Ванадијум | В |
| Тунгстен | В |
| Ксенон | Ксе |
| Цинк | Зн |
| Цирконијум | Зр |

Пратите са:
