Дефиниција квантних бројева
Мисцелланеа / / December 29, 2021
Концептуална дефиниција
Квантни бројеви су дефинисани као целобројне вредности које нам омогућавају да идентификујемо положај електрона унутар атома (у његовој екстра нуклеарној зони) и тако можемо да га идентификујемо.

Хемијски инжењер
Квантни бројеви су скуп бројева представљених словима који, у зависности од положаја електрон на које се односе, узимају различите вредности унутар могућег домета. Сада идемо на описати сваки од њих и видећемо примере како се примењују према електрону који желимо да означимо.
Главни квантни број ("н")
Уско је повезано са Енергија које поседује електрон. Што је веће „н”, већа је енергија, пошто је овај број повезан са величином орбитале. Математички нам говори период у коме се електрон налази, а као што знамо из електронских конфигурација елемената Периодни систем, физички их има до седам нивоа енергије. Дакле, "н" може да варира од један до седам у зависности од удаљеност на коме се налази електрон атома.
Секундарни или азимутални квантни број ("ℓ")
Овај број дозвољава идентификују енергетски подниво који електрон заузима, па, опет, што је већи азимутални квантни број, то је већа енергија коју електрон има. Математички, "ℓ" ће представљати поднивое "с", "п", "д" и "ф" на којима идентификујемо електронске конфигурације елемената Периодног система. Због тога може узети вредности у распону од нула до ("н" -1) где је "н" главни квантни број.
На пример, ако је н = 1, онда ℓ може бити само нула, пошто одговара енергетском поднивоу "с". Док, ако је н = 2, ℓ може да вреднује и нулу и један, пошто се можемо односити на електрон поднивоа "с" или поднивоа "п", респективно. На овај начин идентификујемо: ℓ = 0 за енергетски подниво „с”, ℓ = 1 за енергетски подниво „п”, ℓ = 2 за енергетски подниво „д” и ℓ = 3 за енергетски подниво „ф”.
Треба напоменути да, према "н", енергетски поднивои "с", "п", "д" и "ф" могу да додају орбитале и, према томе, садрже више електрона. На пример, при н = 1, ℓ = 0 са једним „с“ поднивоом и једном орбиталом која може да садржи два електрона. За н = 2, ℓ = 0 са поднивоом „с” или ℓ = 1 са поднивоом „п” који може да садржи три орбитале и да прими шест електрона.
За н = 3, ℓ = 0 са поднивоом „с“ или ℓ = 1 са поднивоом „п“ који може да садржи три орбитале и прихвати шест електрона или ℓ = 2 са поднивоом "д" који може да садржи пет орбитала и десет електрона.
Коначно, за н = 4, ℓ = 0 са поднивоом “с” или ℓ = 1 са поднивоом “п” који може садржати три орбитале и прихватити шест електрона или ℓ = 2 са подниво "д" који може да садржи пет орбитала и смешта десет електрона или ℓ = 3 са поднивоом "ф" који може да садржи седам орбитала и кућу четрнаест електрона.
Ако бисмо желели да представимо ове орбитале у свемиру, њихов облик би био отприлике следећи:
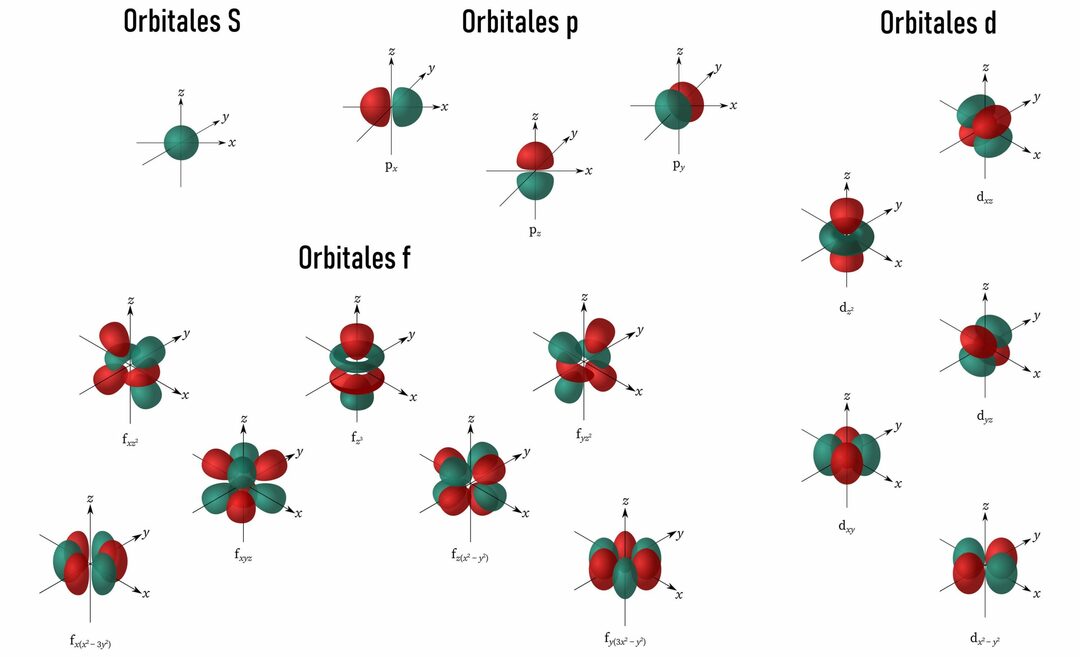
Имг: ЦхемистриГод
Магнетни квантни број ("м")
Повезан је са оријентацијом орбитале у простору и повезан је са бројем орбитала које сваки подниво има. Према томе, вредност коју узима креће се од „-ℓ“ до „ℓ“. На пример, за ℓ = 1, подниво „п“ садржи до 3 орбитале, тако да „м“ добија вредности као што су -1, 0 или 1. Слично, за ℓ = 2 подниво "д" садржи до 5 орбитала, тако да "м" може бити: -2, -1, 0, 1 или 2. Слично, завршава се за ℓ = 0 или ℓ = 4.
Спин квантни број ("с")
Односи се на магнетна својства електрона и служе за идентификацију смера ротације електрона који се налазе унутар исте орбитале, пошто ће сваки од њих имати другачији предзнак. Дакле, "с" може имати вредност од +1/2 или -1/2.
Узмимо хлор као пример, да идентификујемо квантне бројеве у његовим електронима смештеним на последњем енергетском нивоу. За ово морамо знати његову електронску конфигурацију, а то је: 1с2 2с2 2 П63с23п5. Електрони последњег нивоа су они смештени на нивоу 3, тако да: н = 3. Затим, ℓ = 0 или ℓ = 1, за електроне смештене у поднивоима "с" или "п", респективно.
Сада, за ℓ = 0 (3с2), м = 0 и с вреди +1/2 и -1/2 у сваком од електрона који се тамо налазе. За ℓ = 1 (3п5), м = -1,0,1, док с вреди +1/2 и -1/2 респективно у сваком од електрона који су тамо смештени за м = -1 и 0, док Орбитала означена као м = 1 није комплетна са два електрона, тако да морамо изабрати с = +1/2 или -1/2, шта год је изабрано по конвенцији.
Теме из квантних бројева


