Дефиниција молекуларне геометрије
Мисцелланеа / / January 11, 2022
Концептуална дефиниција
То је структура молекула која одређује тродимензионални распоред атома који га чине у свемиру.

Хемијски инжењер
Молекуларне геометрије су тренутно дефинисане на основу теорија одбијања електронских парова слоја Валенсије (ТРПЕЦВ). Ова теорија омогућава предвиђање понашања хемијски супстанци (посебно ковалентних) и помаже у разумевању дистрибуција електронике, што доводи до геометрија од молекула. Ово нам, заузврат, омогућава да разумемо многа својства која супстанце стичу.
Ова теорија је заснована на низу фундаменталних стубова које ћемо размотрити, а затим покушати да их разумемо апликација пракса. На првом месту, везани и невезани (валентни) електрони се сматрају морем електрона које, поседују исту врсту наелектрисања, одбијају једни друге, тако да ће се увек налазити што даље од централног атома молекула.
Друго, ово "море" електрона или "електронски облак" формира области високе електронске густине, који се састоје у везама, где су електрони заједнички или у паровима електрона који се не деле. Заузврат, везе које се формирају могу бити једноструке, двоструке или чак троструке.
Коначно, за одлучити молекуларне геометрије, веома је корисно имати Луисову структуру, где ће се бројати количина електронске густине око централног атома и то ће дати индикација од назива његове геометрије и облика који молекул поприма тродимензионално.
Треба напоменути да ће ове густине бити лоциране што је могуће даље, како би усвојиле што стабилнију структуру и где има мање одбијања. Тако се прво идентификује електронска геометрија, а затим молекуларна геометрија.
Шест нивоа густине
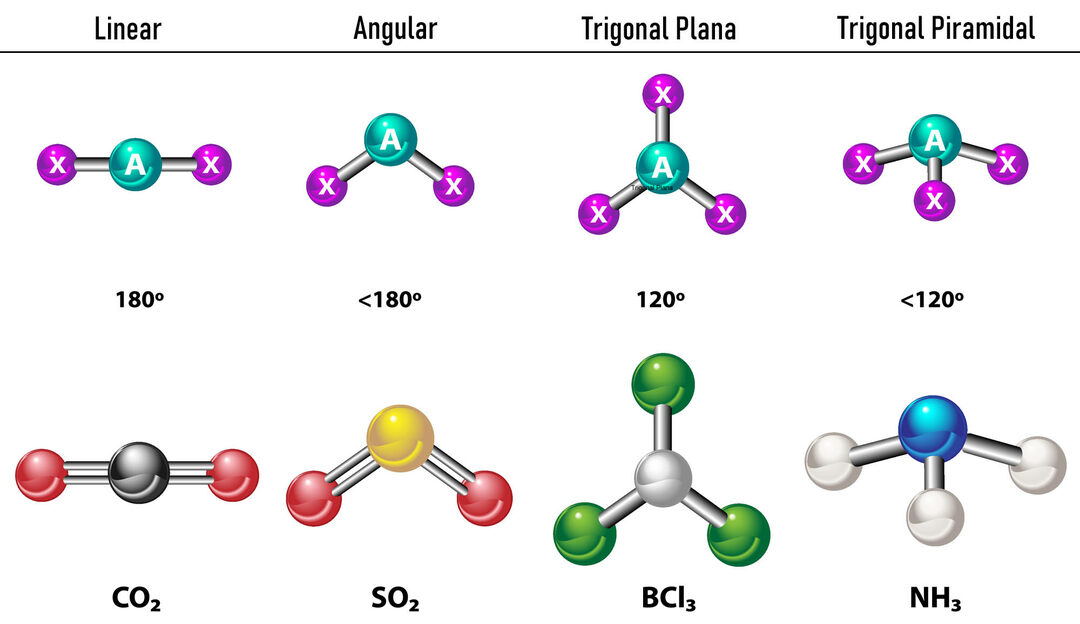
У случају да постоје две електронске густине око централног атома, везе ће се налазити што даље између њих, то јест 180º један од другог и, стога, њихова електронска геометрија је линеарна и молекуларно је такође линеарна.
У случају да постоје три електронске густине око централног атома, постоје две опције: три везе или две везе и један невезани пар. Ако постоје три везе, електронска геометрија је Тригонал Флат, са угловима од 120º између веза и молекуларна геометрија носи исто име. Сада, ако постоји невезани пар, они се одбијају са више интензитет да везана наелектрисања стога теже сабијању углова везе. Угао између слободног пара и сваке везе је 120º, а електронска геометрија је тригонална раван, док је молекуларна геометрија угаона.
У случају да постоје четири електронске густине око централног атома, електронска геометрија је тетраедарска. Ако су сва четири пара електрона везана, њихова молекуларна геометрија се по имену поклапа са њиховом електронском геометријом и угао везе је 109,5º. Сада, ако је један од парова слободан, угао везе постаје мањи (107º) и молекуларна геометрија је типа Тригонална пирамида. Коначно, ако су два слободна пара и два повезана, угао везе је 104,5º, док се молекуларна геометрија назива Угаони.
Када је електронска густина око централног атома пет, то се назива а Тригонална бипирамида своју електронску геометрију. Ако су сва оптерећења повезана, постоје углови од 120ºЦ између екваторијално лоцираних карика и 90º између аксијалних и еквиторијалних. Сада, молекуларна геометрија се такође назива тригонална бипирамида, док, са четири повезана пара и једним слободним паром, молекуларна геометрија је искривљена формирајући добро познату "роцкер”, Ту је и име које добија Искривљени тетраедар. Док, ако су два од пет парова електрона слободна, а три повезана, он има геометрију у облику слова „Т“ и његово име је управо због његове структуре. Коначно, ако је обрнуто, три слободна пара и два везана набоја, молекуларна геометрија је линеарна.
Коначно, око централног атома постоји шест електронских густина и формира се октаедар, отуда и његово име у електронској геометрији. Слично, молекуларна геометрија се именује ако су сви њени парови повезани. Ако имате пет повезаних парова и један слободан пар, молекуларна геометрија је пирамида квадратне базе. Ако имате четири везана пара и два слободна пара, молекуларна геометрија је Скуаре Флат.
Слика: Слатка природа
Теме из молекуларне геометрије

