Концепт у дефиницији АБЦ
Мисцелланеа / / April 22, 2022
дефиниција појма
Азеотропи су мешавине хемијских једињења, дефинисаног састава, које кључају на одређеним температурама. Основна карактеристика је да се смеша понаша као да је једна чиста супстанца, чувајући своје особине и омогућавајући лакоћу руковања.

Хемијски инжењер
Смеша се може дати од две или више компоненти и њене састав исто је и у течној и у гасној фази, ово ствара сличности са чистим супстанцама. Из овога се лако може закључити да се ова смеша не може раздвојити на своје компоненте процесима као нпр фракциона дестилација јер ће, као што је горе поменуто, задржати своје пропорције, понашајући се као да је једно саставни део.
Друга карактеристика је да тачка кључања ове мешавине може бити виша, нижа или чак једнака оној једне од њених компоненти. Када азеотроп прокључа на а температура максималног кључања, познат је као максимални азеотроп, а када то ради на најнижој могућој температури познат је као минимални азеотроп. То значи да минимални азеотроп има нижу тачку кључања од његових чистих компоненти и обрнуто са максималним азеотропом. На пример, у смеши метанол - бензол, азеотроп је минималан (0,61 бензен - 0,39 метанол у фракцијама молар) чија је тачка кључања 58 °Ц, у резервоару где је тачка кључања бензена 80 °Ц, а метанола ден: 65°Ц
Минимални и максимални азеотропи
Сада... одакле долази азеотроп? Када дође до одступања од Закон Раоулт-а, односно притисак паре азеотропне смеше није директно повезан са њеном моларном фракцијом, већ када настаје концепт азеотропне смеше. Ова одступања настају када се компоненте значајно привлаче или одбијају, односно међумолекулске силе су веома различите у различитим једињењима.
Када је одступање позитивно, имамо минимални азеотроп, док ако је одступање негативно имамо максималан азеотроп. Да бисмо боље разумели овај концепт, погледајмо неке графике:
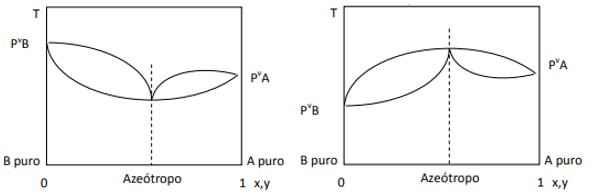
Овде примећујемо да, ако је смеша идеална, према Раоултовом закону, притисци паре чистих компоненти треба да буду спојени правом линијом, пошто па, постоји одступање од тог закона које изазива формирање минималних и максималних азеотропа, у зависности од тога да ли постоји већи или мањи афинитет између компоненте. Када је одступање од Раоултовог закона негативно, као на слици лево, оно је минимум на дијаграм притиска, али максимум у дијаграму температуре (дакле, азеотроп максимума). С друге стране, ако је одступање позитивно на Раоултов закон, то ће бити максимум у притиску вс. састава, али минимум у дијаграму температуре вс. састав (овде имамо минимални азеотроп). Не мешајте дијаграме притиска и. састав и температура вс. састав.
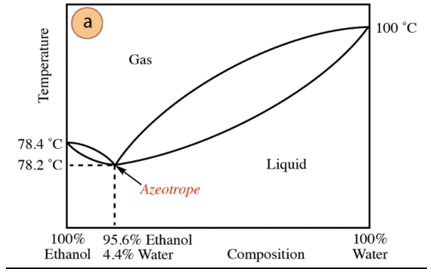
У случају мешавине етанол-вода постоји минимални азеотроп чији је састав 95,6% етанола и 4,4% воде. Температура кључања азеотропне смеше је за 78,2 °Ц нижа од температуре чистих компоненти. Дакле, претпоставимо дестилацију мешавине воде и етанола са високим садржајем воде (близу 100%). Неће бити могуће добити чист алкохол, јер ће се у свакој фази дестилације добити веће фракције. етанола, али никада не достижући 100%, постепено ће се приближавати саставу азеотропне смеше (најнижа тачка под). Зато, као и вода, има тенденцију да формира минималне азеотропе са органска једињења (с обзиром на врсту међумолекулских сила које делују), потребно је претходно уклонити воду из смеше да би се добило чисто једињење. Или, када се добије азеотроп, методе за екстракција додатне воде.
На основу наведеног, није случајно пронаћи алкохол (у самопослузи и апотека) са 95% је најјефтинији производ који се може добити. За добијање чистог алкохола потребно је "разбити" азеотроп со техника додатно, као што је употреба средстава за сушење или азеотропне дестилације. Азеотропна дестилација се састоји од додавања додатне компоненте у смешу која делује повлачењем и интеракција са било којом од компоненти смеше (већи афинитет) може се уклонити из смеше.
Теме у Азеотропима