20 примера амида
Примери / / November 06, 2023
Тхе амиди су органска хемијска једињења деривати карбоксилних киселина, где је хидроксилна група (-ОХ) карбоксилне групе (-ЦООХ) киселине замењена амино групом (-НХ2, -НХ-Р, -Н-(Р)2, Р је било који угљенични ланац).
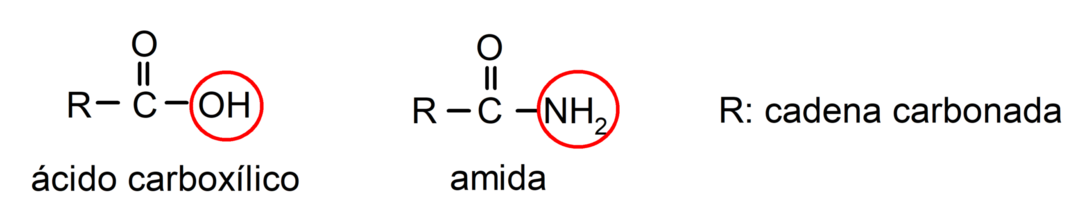
Амиди су органски молекули који садрже амидну групу, која се састоји од карбонил групе и амино групе. На пример: етанамид, пропанамид и Н-метил-етанамид.

- Такође видети: Алдехиди и кетони
Врсте амида
Амиди се могу класификовати према броју водоника (који су везани за азот амино групе) који су замењени различитим супституентским групама. У том смислу постоје примарни, секундарни и терцијарни амиди.
- Примарни амиди. Они су амиди који немају супституисане водонике амино групе. На пример:

- Секундарни амиди. Они су амиди који имају супституисан један од водоника амино групе. На пример:

- Терцијарни амиди. Они су амиди који имају два супституисана водоника амино групе. На пример:

Номенклатура амида
Према уобичајеној номенклатури, амиди се називају као деривати карбоксилних киселина по следећим правилима:
- Угљеник који одговара карбонилној групи налази се на позицији 1 и од овог угљеника се бира најдужи ланац угљеника. На пример:

- Примарни амиди се именују коришћењем префикса који одговара броју атома угљеника карбоксилне киселине која их је изазвала. На пример:

Према Међународној унији за чисту и примењену хемију (ИУПАЦ), амини Они се именују по следећим правилима:
- Секундарни и терцијарни амиди се именују коришћењем префикса који одговара броју атома угљеника карбоксилне киселине која их је изазвала. Даље, за сваки водоник амино групе која је супституисана, ставља се Н. Дакле, различити супституенти се именују означавајући њихову количину, а на крају назива се ставља реч амид. На пример:

- Када молекул има приоритетне групе у односу на амидну групу, тада се амид именује као супституент. У овим случајевима амидна група се зове карбамоил. На пример:
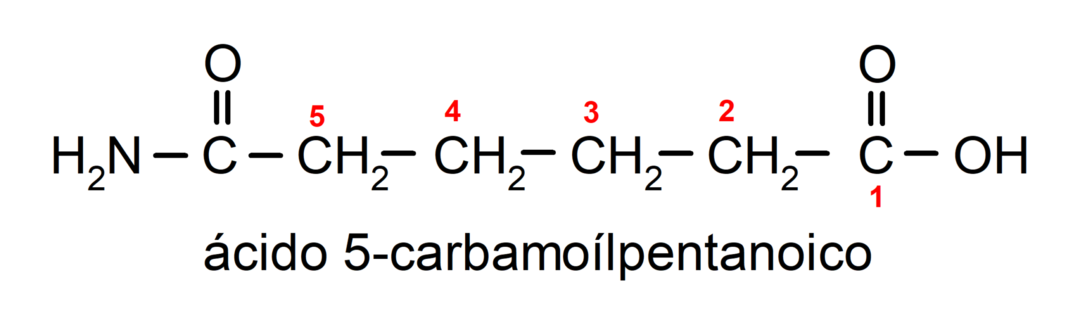
- Када се молекул формира од циклуса и амидне групе, циклус се узима као главни ланац и ставља се суфикс -карбоксамид. На пример:

Физичка својства амида
- Амиди су чврсти на собној температури, са изузетком метанамида.
- Имају високе тачке кључања, чак и веће од оних одговарајућих карбоксилних киселина.
- Амиди су добри растварачи.
- Они су слабе базе.
Хемијске реакције амида
- Амиди реагују са воденом киселином да би се формирала одговарајућа карбоксилна киселина и амонијумова со. На пример:

- Амиди реагују са алкалијама и формирају одговарајућу карбоксилну киселину и карбоксилатну со. На пример:
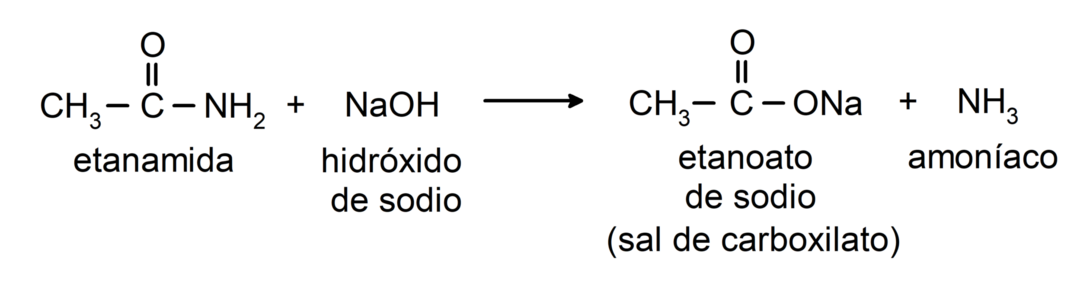
- Амиди се редукују у амине у присуству литијум алуминијум тетрахидрида:
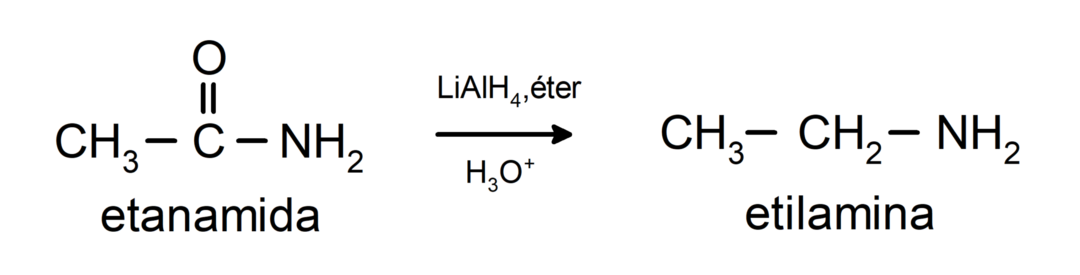
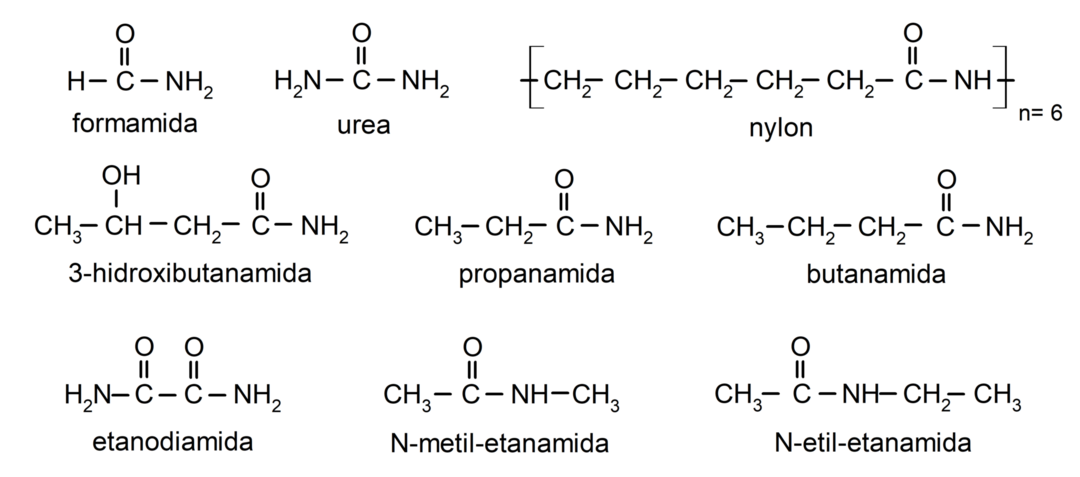
Примери амида
- формамид
- уреа
- најлон
- ε-капролактам
- етанамид
- пропанамид
- бутанамид
- етандиамид
- Н-метил-етанамид
- Н-етил-етанамид
- Н-пропил-етанамид
- Н, Н-диметил-бутанамид
- бензенкарбоксамид
- 4-бромо-3-метил-циклохексанкарбоксамид
- 3-хидроксибутанамид

Употреба амида
Амиди се широко користе у фармацеутској индустрији. Поред тога, користе се као компоненте за отпуштање калупа у индустрији пластике. С друге стране, користе се као емулгатори, сурфактанти и растварачи. На пример, уреа је амид који се широко користи у фармацеутској индустрији и индустрији најлона.
Референце
- Рамирез-Барон, С. Н., Саенз-Галиндо, А., Лопез-Лопез, Л., & Цанту-Сифуентес, Л. (2013). Амиди, примена и синтеза. Научни часопис Аутономног универзитета Коауила, 5(9).
- Каљери, С. Ц., & Пагнан, М. (2013). Теоријска студија о киселој хидролизи алифатичних и ароматичних амида. Технолошке информације, 24(3), 35-40.
- Мартинез, Ц. Х. М., Гомез, Л. И. П., де Ескобар, М. С., & Есцаланте, Ф. ДО. (2002). органска хемија. Универзитет Лас Палмас де Гран Канарија, проректорат за студије и квалитет наставе.
Пратите са:
- Алдехиди
- Алцохолс
- Макронутријенти и микронутријенти
- Органска и неорганска једињења
