30 примера алкохола
Примери / / November 06, 2023
Тхе алкохоли су органска хемијска једињења који у својој структури садрже хидроксилну функционалну групу (- ОХ) везану за угљеник (- Ц). Група (- Ц – ОХ) се назива "карбинол". Неки примери алкохола су: метанол, етанол и 1-пропанол.
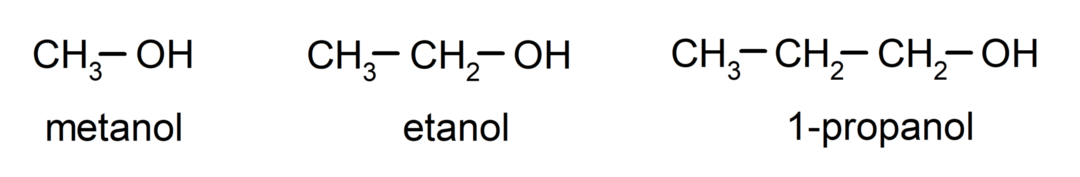
Алкохоли су хемијска једињења са различитим применама у свакодневном животу, јер имају антибактеријска и антисептичка својства. С друге стране, могу бити опасни по људско здравље када се неконтролисано гутају.
Исто тако, људи не могу унети све алкохоле.
- Такође погледајте: Амини и кетони
Врсте алкохола
У зависности од броја атома угљеника за које је везан атом угљеника за који је везана хидроксилна група, алкохол може бити:
- Примарни алкохол. Атом угљеника за који је везана хидроксилна група такође је везан за један атом угљеника. На пример:
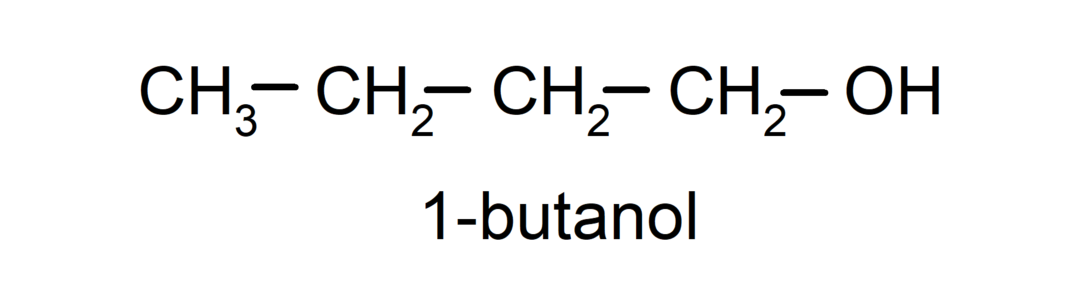
- Секундарни алкохол. Атом угљеника за који је везана хидроксилна група такође је везан за два друга атома угљеника. На пример:
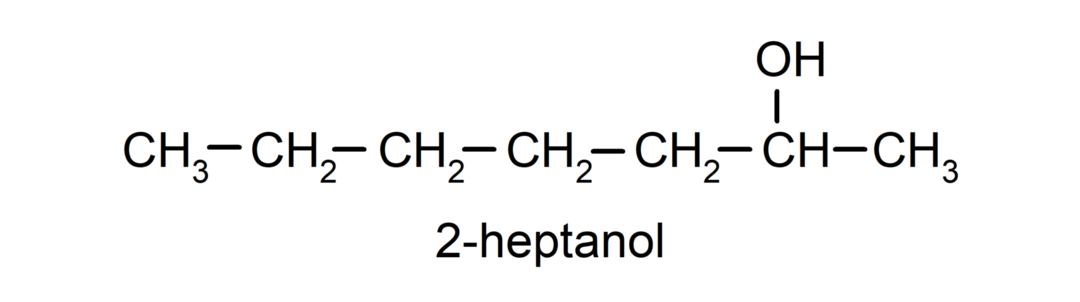
- Терцијарни алкохол. Атом угљеника за који је везана хидроксилна група такође је везан за три атома угљеника. На пример:
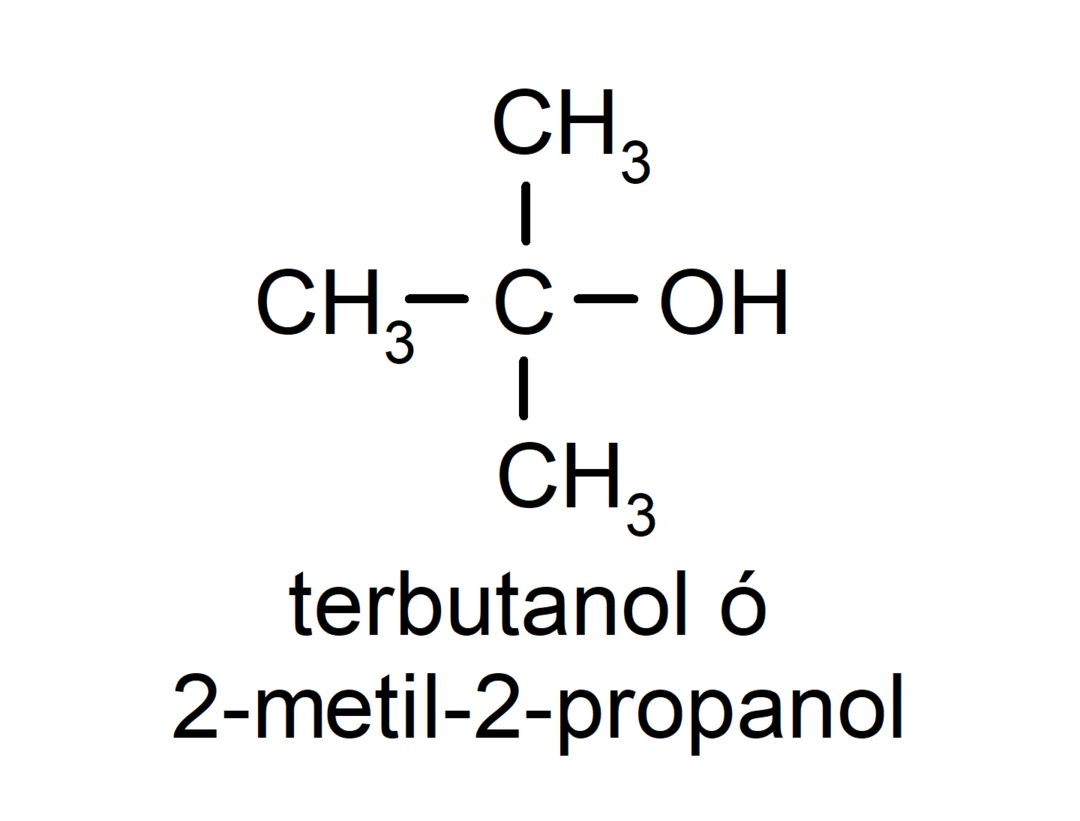
У зависности од броја хидроксилних група које има, алкохол може бити:
- Диол. У својој структури има две хидроксилне групе. На пример:
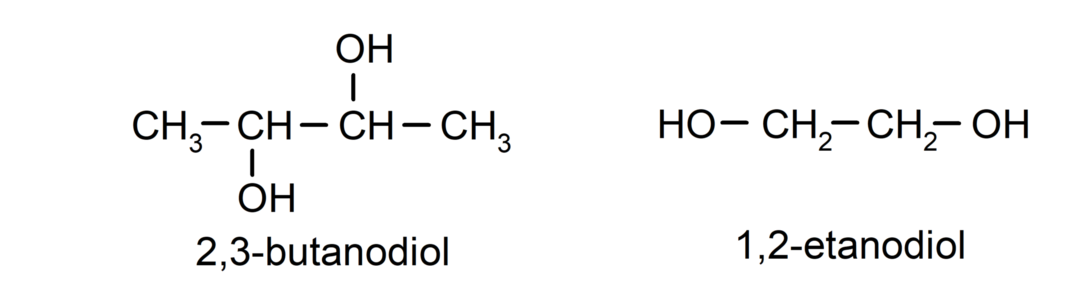
- Триол. У својој структури има три хидроксилне групе. На пример:
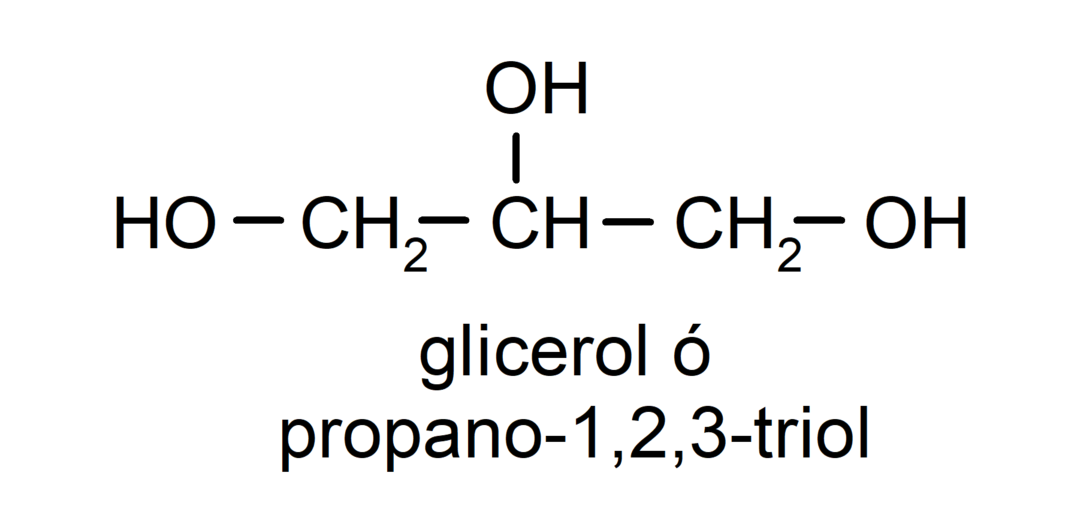
- Полиалкохол. У својој структури има много хидроксилних група. На пример:
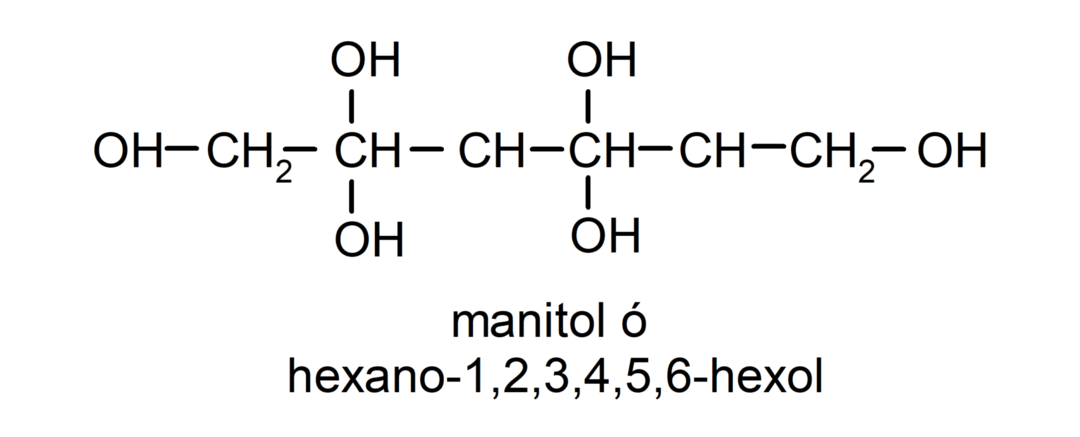
Физичка својства алкохола
Нека од физичких својстава алкохола су:
- Тачка кључања. Тачка кључања у алкохолима је прилично висока због присуства хидроксилне групе, што омогућава стварање водоничних веза. Штавише, што је више хидроксил функционалних група присутно у ланцу угљеника, то је већа Тачка кључања од алкохола.
- Поларитет. Алкохоли су прилично поларна једињења.
- Растворљивост. Нискомолекуларни алкохоли су растворљиви у води. С друге стране, што је већи угљенични ланац алкохола, то је мања њихова растворљивост у води. Додатно, што више хидроксилних група имају алкохоли, то је већа њихова растворљивост у води.
- Стање агрегације. Већина алкохола је течна на собној температури (25ºЦ) и има карактеристичне мирисе.
Хемијска својства алкохола
Нека од хемијских својстава алкохола су:
- Алкохоли се понашају као киселине и базе.. Њихово понашање као киселина може се видети у реакцијама са активним металима да ослобађају гас водоника и формирају алкоксиде.

Њихово понашање као база може се видети у реакцијама као што је реакција метанола са бромоводоником да би се формирао метилоксонијум бромид.
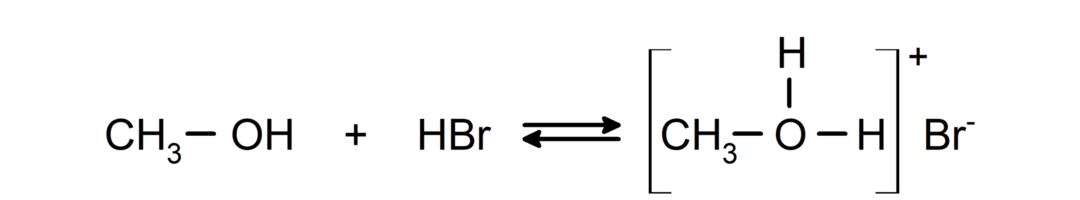
- Алкохоли се подвргавају реакцијама халогенације. Реагују са водоник-халогенидима и формирају алкил халогениде.
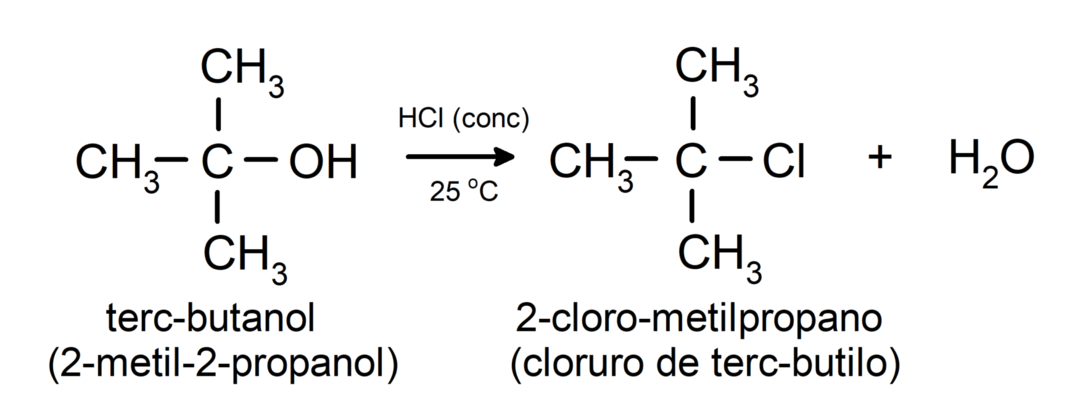
-
Алкохоли пролазе кроз реакције оксидације када реагују са одређеним оксидационим једињењима. Производи оксидационих реакција зависе од типа алкохола који реагује, односно да ли је примарни, секундарни или терцијарни.
Оксидација примарног алкохола до формирања алдехида или карбоксилне киселине.
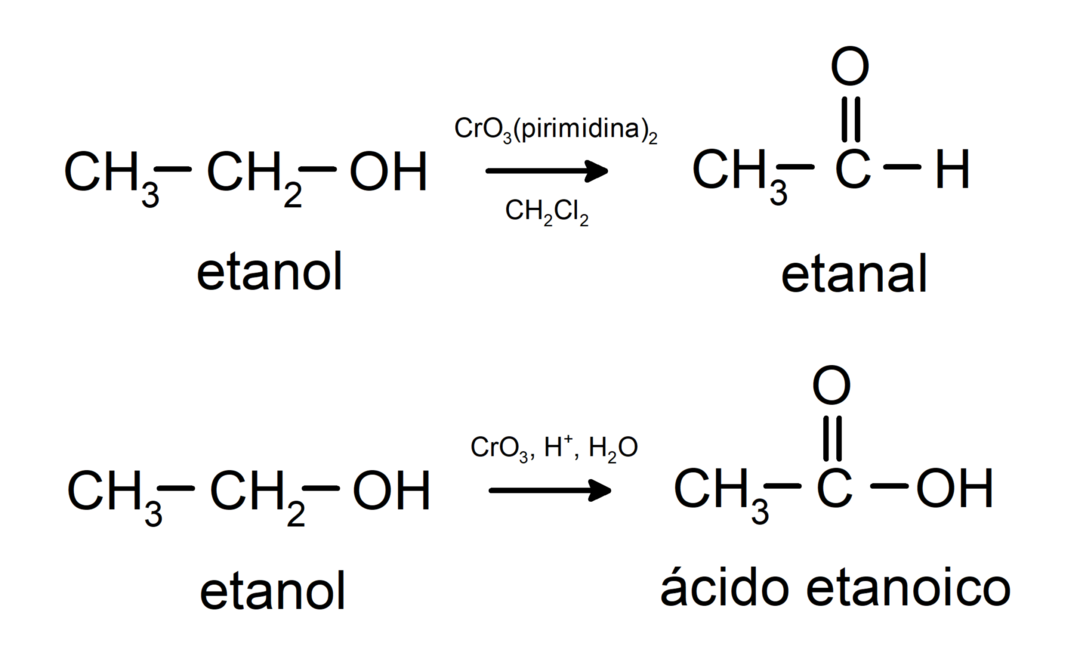
Оксидација секундарног алкохола до стварања кетона.
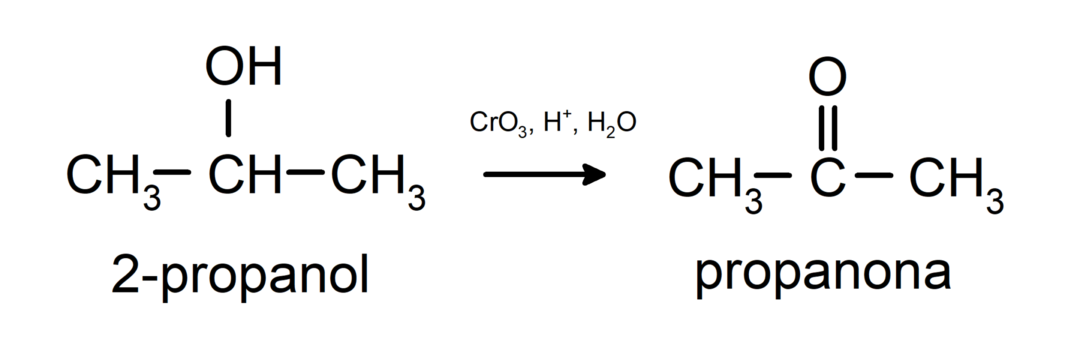
Терцијарни алкохоли не оксидирају са уобичајеним оксидантима. Са веома јаким оксидационим агенсима могу се трансформисати у алкене, који се затим могу оксидовати.
Алкохоли који имају две хидроксилне групе смештене на суседним угљеницима оксидују се оловним тетраацетатом да би се формирала два кетона.
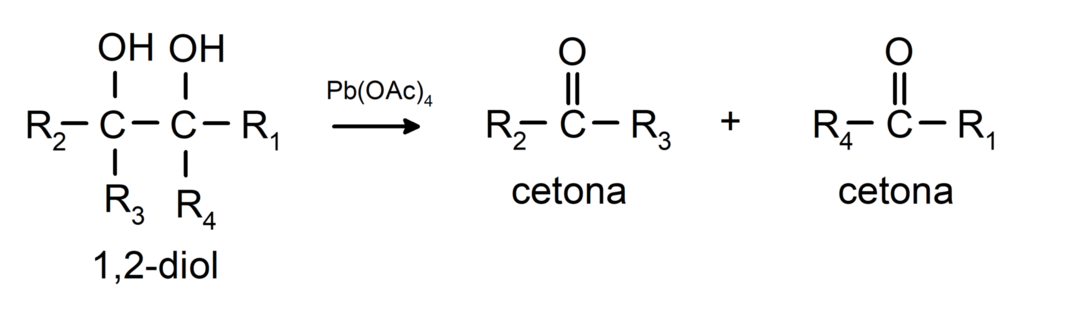
- Алкохоли пролазе кроз реакције дехидрогенације. Ове реакције се дешавају само са примарним и секундарним алкохолима, који када су подвргнути високим температурама у присуству катализатора, ослобађају водонике.
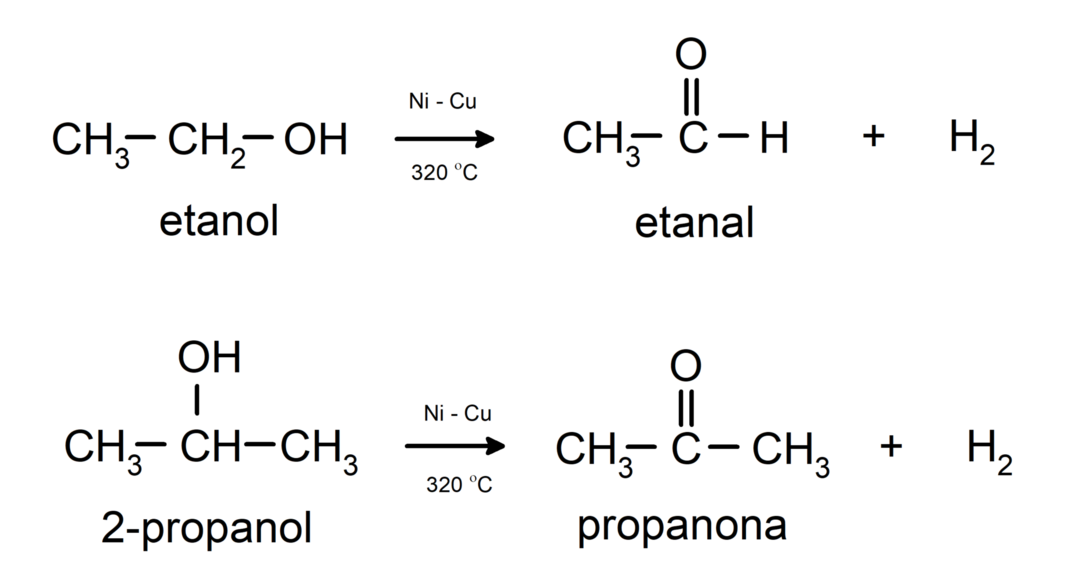
- Алкохоли су подвргнути реакцијама дехидрације. Алкохоли дехидрирају да би формирали одговарајуће алкене. Ова реакција се дешава у присуству киселине и средњих температура.
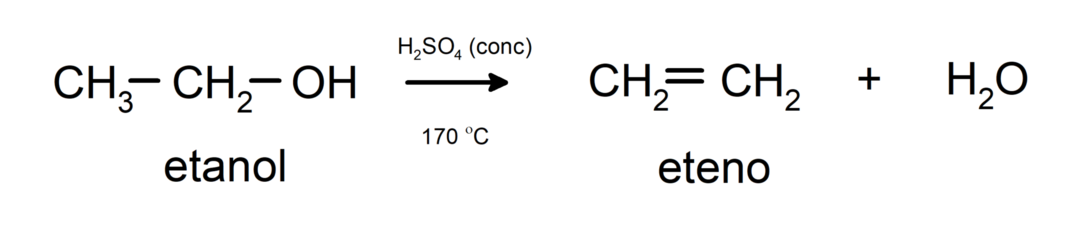
Номенклатура алкохола
Према номенклатури коју је установио ИУПАЦ (Међународна унија чисте и примењене хемије), алкохоли се називају према следећим правилима:
- Положај хидроксилне групе се бира узимајући у обзир да она заузима најмањи могући број у ланцу угљеника. Ако је структура алкохола циклична, узима се у обзир 1. позиција на угљенику за коју је везана хидроксилна група и префикс цицло- се користи за његово именовање.
- Назив алкохола пише се помоћу префикса који означавају број атома у ланцу угљеника, а поред тога се ставља суфикс -ол.
- Ако структура алкохола има гране, као главни угљенични ланац бира се најдужи ланац који такође садржи хидроксилну групу.
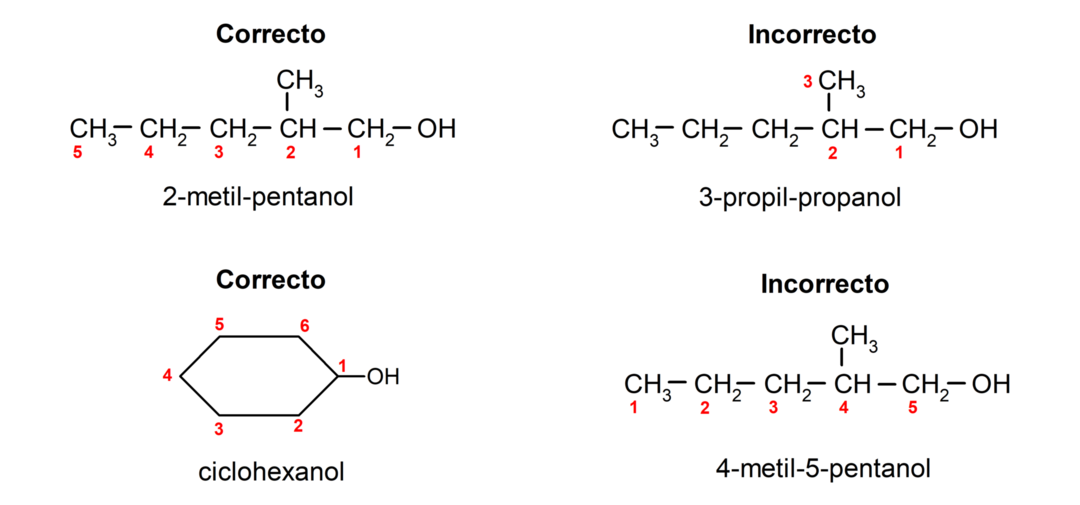
Према традиционалној номенклатури, алкохоли се именују тако што се напише реч „алкохол“, а затим се напише назив алкохола. алкан који одговара угљеничном ланцу, али уместо употребе -ане завршетка алкана, завршетак -иллиц.
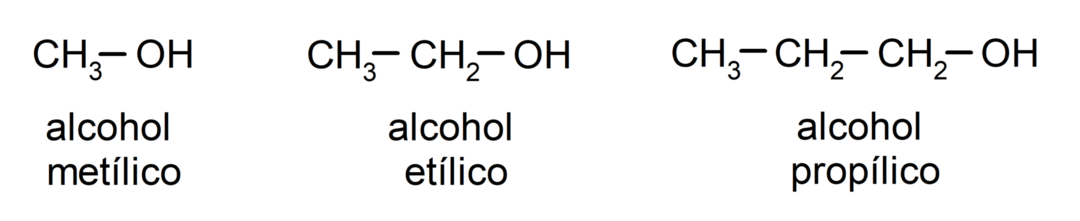
Примери алкохола
- метанол
- етанол
- 1-пропанол
- 2-пропанол
- 1-бутанол
- 3-етилхексан-2-ол
- глицерол
- фенол
- 2-метил-2-бутанол
- 1,2-етхандиол
- 1,5-хептадиен-3-ол
- 3-метил-2-бутанол
- бензилметанол
- 3-пентанол
- 2-метилфенол
- 1,2-дихидроксифенол
- цицлохеакнол
- 1-фенилетанол


Употреба алкохола
Најчешће употребе алкохола су:
- Користе се као дезинфекциона средства и антисептици јер заустављају раст неких микроорганизми или их уништити. У ту сврху се највише користе етанол и изопропил алкохол.
- Користе се у синтези различитих хемијска једињења. Метанол се, на пример, користи за добијање метанала (формалдехида).
- Користе се за производњу антифриза. Метанол је један од најчешће коришћених за ову сврху.
- Користе се као растварачи у фармацеутској индустрији. Етанол је један од најчешће коришћених у овом смислу.
- Користе се као растварачи за лакове, боје и мастила. Метанол се широко користи у ове сврхе.
- Користе се као гориво и постоји значајна тенденција да се делимично замењује употреба фосилна горива коришћењем биоетанолног горива.
- Користе се за прављење смола. У том смислу се користи фенол.
Опасности од конзумирања алкохола
Иако је конзумирање алкохола данас друштвено прихваћено, злоупотреба ове супстанце ствара зависност и зависност.
Етанол је алкохол присутан у алкохолним пићима, који када се конзумира у прекомерној количини утиче когнитивне способности, а може изазвати кардиоваскуларне болести, цирозу јетре и рак.
Даље, када се достигне степен интоксикације алкохолом, односно стање пијанства, ако се доза алкохол је превисок, може доћи до алкохолне коме, што може довести до респираторне парализе, па чак и смрти. смрти.
Референце
- Т. ДО. Геиссман. (1974) “Принципи органске хемије” друго издање. Едиториал Реверте, С.А. ИСБН: 8429171800
- Ахумада-Кортез, Ј. Г., Гамез-Медина, М. Е., и Валдез-Монтеро, Ц. (2017). Конзумација алкохола као јавноздравствени проблем. Ра Ксимхаи, 13(2), 13-24.
- Морисон, Р. Т., & Боид, Р. Н. (1998). Органска хемија. Пеарсон образовање.
- Веинингер, С. Ј., & Стермитз, Ф. Р. (1988). Органска хемија. Обрнуо сам.
Пратите са:
- Етил алкохол
- Горива
- органска хемија
