30 примера бинарне продаје
Примери / / November 09, 2023
Тхе бинарне соли (неутралне соли) настају када се споје метал и неметал. Аре хемијска једињења састављена само од два хемијски елементи. На пример: натријум хлорид (НаЦл) и калијум бромид (КБр).
- Такође видети: Метали и неметали
Примери бинарних соли
- натријум хлорид (НаЦл)
- Гвожђе(ИИ) хлорид (ФеЦл2)
- Гвожђе(ИИИ) хлорид (ФеЦл3)
- Кобалт(ИИ) сулфид (ЦоС)
- Кобалт(ИИИ) сулфид (Цо2да3)
- Олово(ИИ) сулфид (ПбС)
- Олово(ИВ) сулфид (ПбС2)
- Калцијум хлорид (ЦаЦл2)
- натријум флуорид (НаФ)
- литијум хлорид (ЛиЦл)
- стронцијум хлорид (СрЦл2)
- Баријум хлорид (БаЦл2)
- Алуминијум хлорид (АлЦл3)
- Магнезијум сулфид (МгС)
- Рубидијум хлорид (РбЦл)
- Калцијум бромид (ЦаБр2)
- Калијум сулфид (К2С)
- Магнезијум бромид (МгБр2)
- Цинк сулфид (Зн2С)
- Литијум бромид (ЛиБр)
- Никл хлорид (НиЦл2)
- Уранијум(ИИИ) хлорид (УЦл3)
- Сребрни бромид (АгБр)
- Сребрни јодид (АгИ)
- Калијум бромид (КБр)
Номенклатура бинарних соли
Према традиционалној номенклатури, бинарне соли се именују писањем имена неметалног елемента са завршетком -иде. С друге стране, назив металног елемента пише се према његовом оксидационом стању:
- За најниже оксидационо стање пише се са завршетком -осо. На пример: гвожђе хлорид (ФеЦл2), где гвожђе има оксидационо стање 2+.
- За највеће оксидационо стање пише се са завршетком -ицо. На пример: гвожђе хлорид (ФеЦл3), где гвожђе има оксидационо стање 3+.
Према Систематској номенклатури, бинарне соли се именују тако што се име неметалног елемента упише са префиксом који означава количину атоми овог елемента у једињењу. Поред тога, у називу неметалног елемента ставља се завршетак -уро. Затим се поставља назив металног елемента. На пример: магнезијум дихлорид (МгЦл2) и гвожђе трихлорид (ФеЦл3).
Према Стоцковој номенклатури, бинарне соли се именују писањем имена неметалног елемента са завршетком -иде. Затим се ставља назив металног елемента иза којег следи његово оксидационо стање написано римским бројевима и у загради. На пример: гвожђе(ИИ) хлорид (ФеЦл2) и кобалт(ИИИ) сулфид (Цо2да3).
Примене бинарних соли
- Користе се као расхладна средства у прехрамбеној и фармацеутској индустрији. На пример: калцијум хлорид (ЦаЦл2).
- Користе се за третирање металних површина од корозије. На пример: натријум флуорид (НаФ).
- Користе се за регулацију влажности у папирној и грађевинској индустрији. На пример: калцијум хлорид (ЦаЦл2).
- Користе се у индустрији стакла за уклањање нечистоћа. На пример: силицијум тетрахлорид (СиЦл4).
- Користе се као састојци за кување. На пример: натријум хлорид (НаЦл).
Физичка својства бинарних соли
- Имају високе тачке топљења јер се састоје од јонске везе.
- Они проводе електричну струју када су растворени или растопљени.
- Најчешће соли имају малу тврдоћу.
- Нису компресибилне.
- Већина се може растворити у води.
Како се добијају бинарне соли?
Бинарне соли се могу добити кроз неке од следећих хемијских реакција:
Реакција између метала и неметала. На пример: реакција између натријума (На) и дихлорида (Цл2) производи натријум хлорид (НаЦл).
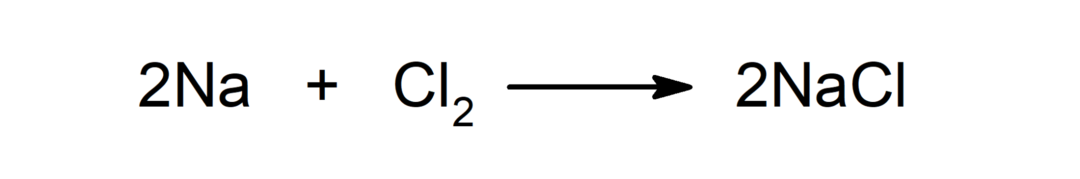
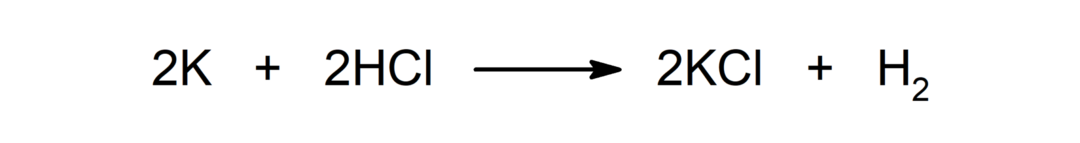
Реакција између метала и киселине. На пример: Реакција између калијума (К) и хлороводоничне киселине (ХЦл) производи калијум хлорид (КЦл) и диводоник (Х2).
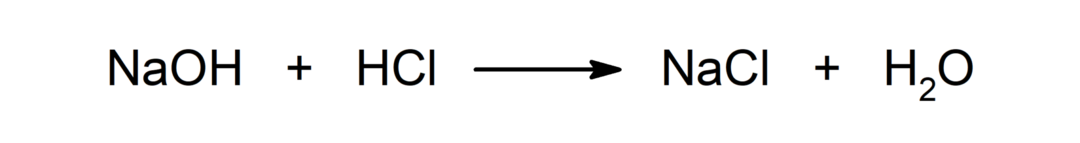
Реакција између киселине и базе. На пример: Реакција између хлороводоничне киселине (ХЦл) и натријум хидроксида (НаОХ) производи натријум хлорид (НаЦл) и воду (Х2ИЛИ).
Пратите са:
- оксисоли
- неутралне соли
- киселе соли
Референце
- Серон Виљалба, А., Новоа Рамирез, Ц. С., и Алпизар Хуарез, Е. (2020). Номенклатура видео 1: бинарне соли и хемијска реакција.
- Акурио Аријас, М. В., и Делгадо Мендес, М. И. (2022). Водич за учење заснован на игрици за „бинарна једињења“ у средњој хемији у образовној јединици „Херлинда Торал“ (Дипломски рад, Национални универзитет за образовање).
- Кабрера, М. Ј. Х. (2005). Проучавање првих принципа електронских и структурних особина бинарних и тернарних једињења (Докторска дисертација, Универзитет Ла Лагуна).


