Примери ендотермних реакција
Примери / / November 09, 2023
А ендотермна реакција То је реакција која апсорбује енергију из медијума у облику топлоте. У овим реакцијама, да би се реактанти трансформисали у продукте, неопходно је да апсорбују топлоту, што доводи до тога да производи имају већу енергију од реактаната који су их настали. Неки примери ендотермних реакција су: фотосинтеза и електролиза воде.
- Такође видети: Хемијске реакције
Примери ендотермних реакција у свакодневном животу
Неке од главних ендотермних реакција су:
Производња озона у атмосфери. Озон се производи у атмосфери када молекуларни кисеоник (О2) апсорбује ултраљубичасто зрачење и разлаже се. Тада атом кисеоника (О) може да ступи у интеракцију са другим молекулом кисеоника (О2) и формирају озон (О3).

Електролиза воде. То је процес којим се примењује електрична енергија у воду да би је раздвојио на две компоненте, водоник (Х) и кисеоник (О).
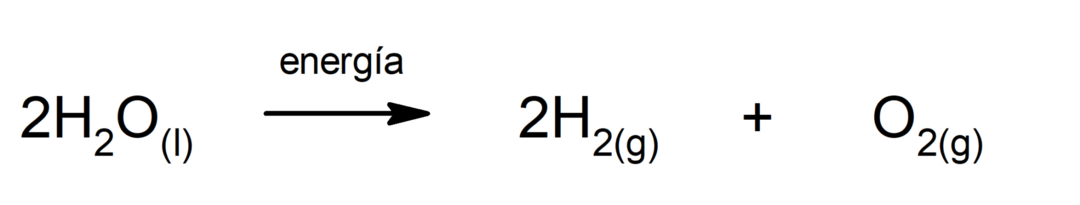
Фотосинтеза. То је хемијска реакција којом се апсорбује соларна енергија, угљен-диоксид (ЦО2) се трансформише у глукозу. Ова реакција представља главни пут исхране биљака.
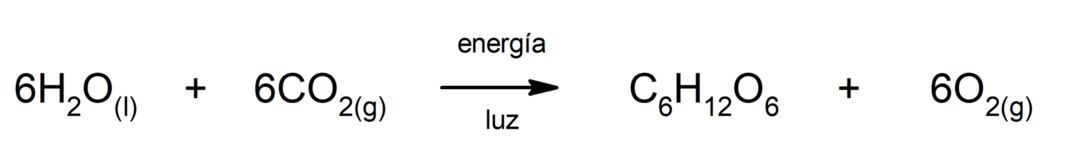
Производња гвожђе(ИИ) сулфида. Да би дошло до реакције између сумпора и гвожђа, потребно је обезбедити енергију у облику топлоте.
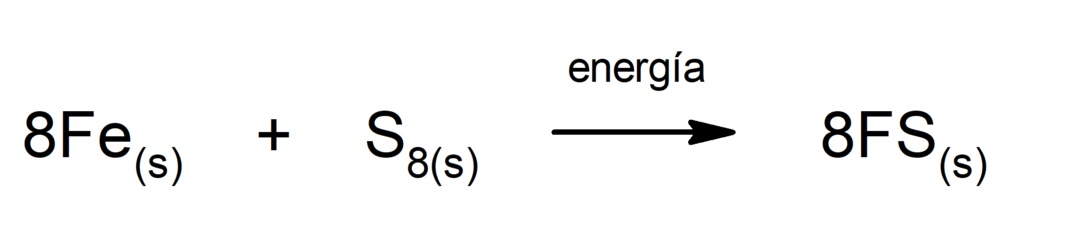
Разлагање угљен-диоксида (ЦО2). Разлагање ЦО2 На високим температурама производи угљен моноксид (ЦО) и кисеоник (О2).
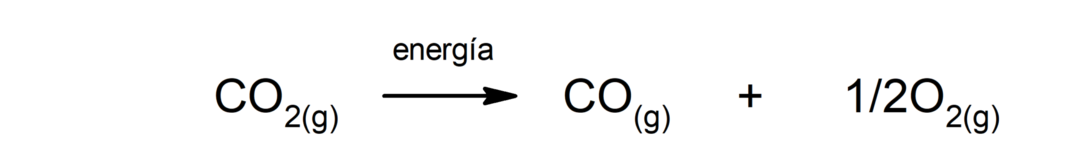
Разлагање калцијум карбоната (ЦаЦО3). Калцијум карбонат се разлаже апсорпцијом топлоте да би произвео калцијум оксид (ЦаО) и угљен диоксид (ЦО2).
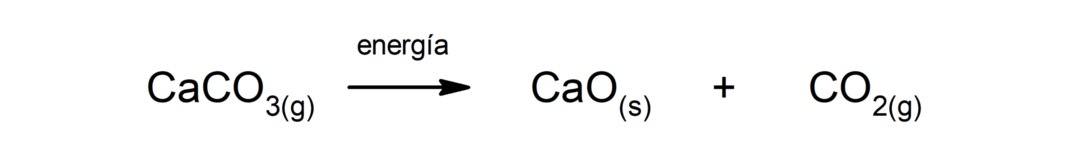
Разлика између ендотермне и егзотермне реакције
Главна разлика између ендотермних и егзотермних реакција је у томе што ендотермне реакције апсорбују топлоту, док егзотермне реакције ослобађају топлоту.
Даље, ендотермне реакције карактерише повећање енталпије, док су егзотермне реакције повезане са смањењем енталпије.
Енталпија је термодинамичка величина која дефинише проток топлотне енергије при константном притиску током хемијске реакције. Представљен је словом Х, а његова варијација је један од главних индикатора за дефинисање да ли је хемијска реакција ендотермна или егзотермна.
- Ако хемијска реакција има промену енталпије већу од нуле (ΔХ > 0) је ендотермна.
- Ако хемијска реакција има промену енталпије мању од нуле (ΔХ < 0) је егзотермна.
Пратите са:
- Физичко-хемијске појаве
- Хемија у свакодневном животу
- Хемија у свакодневном животу
- Органска и неорганска хемија
Референце
- Сото-Кордоба, С. (2016). Ендотермне реакције. Тецх Репоситори Технолошки институт Костарике.
- Короминас, Ј. (2017). Хемијске реакције свакодневног живота. Алембић, (90), 8-26.
- Санчез, М. Т. М., & Санцхез, М. М. (2002). Експериментално проучавање ендотермних реакција за студенте ЕСО. Анали хемије РСЕК-а, (4), 36-39.

