Пример волуметријске анализе
Хемија / / July 04, 2021
на Аналитичка хемија, Волуметрија је метода анализе која се састоји од Мерење запремине реагенса потребног за стехиометријску реакцију са аналитом, која је супстанца коју треба одредити.
Реагујте стехиометријски односи се на супстанце које хемијски међусобно делују, према пропорција која означава хемијску једначину већ уравнотежен.
Супстанца коју треба испитати зове се Аналите. Од ове супстанце ће се узети узорак познате и тачно измерене запремине, коју ћемо назвати Аликуот, која се налази у ерленмајерској тиквици за почетак анализе.
Концепти волуметријске анализе
Волуметријска анализа, као врста Хемијска анализа, носе укључивао хемијску реакцију. Ова хемијска реакција ће се спровести између узорка са непознатом количином испитиване супстанце и познате количине друге супстанце која може да реагује са првом.
Тхе Реакционе супстанце ће бити у воденом раствору, и измераће се запремине раствора који су реаговали да би се постигао крај реакције, што ће бити видљиво захваљујући индикатору који ће дати боју унутар боце.
У волуметријској анализи, водени раствор Позната концентрација назива се стандардно решење, Стандард или Титрант, и служиће као референца за завршетак реакције за израчун који ће открити количину истражене супстанце.
Назван је овај поступак реакције оба решења Хемијски степен о Процена вредности, која је основни део волуметријске анализе. Састоји се од одласка постепено уливање стандардног решења (Титрант) у аликвоту (Узорак), док индикатор не покаже промену са разликом у боји.
А. Показатељ То је хемијска супстанца која се додаје Аликуот-у, показујући обојеност, и која ће по завршетку реакције променити боју.
Волуметријска анализа састоји се од једноставног низа корака:
1.- Припрема стандардног раствора
2.- Припрема узорка или аликвота
3. - Хемијски степен
4.- Мерење запремине
5.- Прорачун истражене супстанце.
До тачке у којој су већ у потпуности реаговао две супстанце, то се зове Тачка еквиваленције.
Као и у било којој хемијској методи анализе, и у волуметријској анализи постоје захтеви за добре резултате:
-Хемијска реакција мора бити СелективноОдносно, стандардно решење ће реаговати само са узорком.
-Хемијска реакција мора бити Стехиометријска, то јест придржавајте се пропорција означених у уравнотеженој хемијској једначини.
-Хемијска реакција мора бити Квантитативан; односи се на 99,9% завршености на тачки еквиваленције.
-Мора да постоји уочљива крајња тачка у реакцији, што ће индикатор боље потврдити.
Примарни образац
Тхе Примарни обрасци То су супстанце високе чистоће чија се концентрација у раствору израчунава директно на основу измерене количине и запремине воде.
А) Да, може реаговати са радним решењима, да се зна концентрација потоњих и претвори у стандардне растворе.
Примери примарних образаца су:
-Сатријум карбонат (На2ЦО3): Користи се за стандардизацију киселина, попут сумпорне киселине.
-Калијум бифталат: Примарни је стандард за припрему стандардних раствора база, као што је натријум хидроксид.
-Содијум хлорид (НаЦл): Користи се за стандардизацију раствора сребровог нитрата.
-Калцијум-карбонат (ЦаЦО3): Примарни стандард за ЕДТА (етилен диамин тетрацетна киселина).
Примарни образац мора испуњавати неколико основних карактеристика:
Мора да има Висока чистоћа, Атмосферска стабилност, Одсуство воде за хидратацију, Ниска цена и лако је доћи, И Велика еквивалентна тежина.
Класификација волуметријске анализе
Зависно од хемијске врсте са којом радите на изради анализе, то ће бити врста волуметрије:
Кисело-базна волуметрија: Ради са киселином или са базом, анализира узорке који садрже киселине или базе.
Волуметрија падавина: Такође названа Аргентометрија, користи стандардно решење сребреног нитрата да би утврдила колико хлорида има у узорку.
Волуметрија сложености: Стандардни раствор агенса за комплексирање, као што је ЕДТА, користи се за мерење концентрације тврдоће, односно калцијума и магнезијума карбоната у води.
РЕДОКС запремина: Реакција се јавља између оксидирајуће супстанце и редукујуће супстанце.
Индикатори
Од бројних показатеља који се користе у волуметрији, издвајају се три:
1.- Метил наранџа: Потребна је наранџаста боја у аликвоту, која ће бити титрирана киселином. Када се достигне тачка еквиваленције, индикатор ће постати жут.
2.- Фенолфталеин: На почетку је прозиран у аликвоту, који ће бити насловљен базом. Када се достигне тачка еквиваленције, индикатор ће постати ружичаст.
3.- Ериохром црна: То је индикатор који се користи за одређивање тврдоће у води. У почетку је у аликвоту љубичаста, све док се не титрише средством за комплексирање. На крају реакције постаје плава.

Инструменти у волуметријској анализи
У волуметријској анализи користиће се низ инструмената који се, уколико нису доступни, не могу адекватно развити:
1. - Волуметријска тиквица: То је посуда попут сијалице у доњем делу, спљоштена на дну, која има танак ступац у који се додаје течност. Има ознаку која означава где треба да буде менискус течности, тако да покрива тачну запремину. Користи се за садржавање стандардних решења; захваљујући тачности његове запремине обезбеђује се позната концентрација.

2.- пипете: То су градуиране танке епрувете које омогућавају поуздано мерење тачних количина течности. Доступни су до 25 милилитара и омогућавају тачно узорковање.
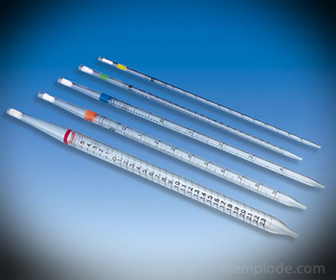
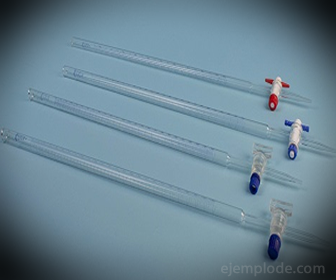
3.- Бирета: То је издужена цев запремине 50 милилитара, која ће садржати стандардно решење. На једном од његових крајева има вентил за регулацију протока који ће одводити раствор у аликвот.
4.- Ерленмајерове боце: То су контејнери са равним дном, стожастог облика који се завршава цилиндричном ивицом. Овај дизајн их чини погодним за хемијске титрације, јер не дозвољавају да се растресање претресе. Ако ће се вршити понављајућа тестирања, биће потребна најмање три, како би се осигурао поуздан резултат.

Прорачуни у волуметријској анализи
Како се рукује воденим растворима, количине које су важне за волуметријску анализу су концентрација и запремина.
Главна једначина волуметрије заснива се на четири главна података:
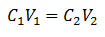
Ц.1= Концентрација узорка (непозната)
В.1= Запремина аликвота, са којим је рађена анализа
Ц.2= Концентрација стандардног раствора која се користи за достизање тачке еквиваленције
В.2= Запремина Стандардно решење потребно за постизање краја реакције
Подаци су замењени у једначини, а само тражена концентрација остаје непозната. Наравно, сви подаци морају бити на истим дисковима.
Примери волуметријске анализе
Одређивање хлорида (Цл-) аргентометријом, са сребрним нитратом.
Одређивање бромида (Бр-) аргентометријом, са сребрним нитратом.
Одређивање цијанида (ЦН-) помоћу аргентометрије, са сребрним нитратом.
Одређивање магнезијум-карбоната (МгЦО3), Комплексометријом, са ЕДТА.
Одређивање калцијум-карбоната (ЦаЦО3), Комплексометријом, са ЕДТА.
Анализа сумпорне киселине (Х.2СВ4) са натријум хидроксидом (НаОХ).
Анализа натријум хидроксида (НаОХ) са хлороводоничном киселином (ХЦл).
Одређивање антимона (ИИИ) калијум перманганатом (КМнО4).
Одређивање арсена (ИИИ) са калијум перманганатом (КМнО4).
Одређивање титана (ИИИ) калијум перманганатом (КМнО4).
Одређивање молибдена (ИИИ) са калијум перманганатом (КМнО4).
Одређивање гвожђа (ИИ) калијум перманганатом (КМнО4).
Одређивање оксалат-јона са калијум-перманганатом (КМнО4).

