Пример хемијске енергије
Хемија / / July 04, 2021
Тхе Хемијска енергија је она која долази од хемијских реакција. Интеракција између хемијских врста генерише пуцање и / или стварање веза, што подразумева ослобађање односно апсорпцију енергије. Хемијска енергија се назива ослобођена енергија, која се, на пример, може користити као топлотна и електрична енергија.
Енергија у хемијским реакцијама
Хемијска енергија се у свом максималном изразу може добити из два главна извора: сагоревањем и електролитским растворима. С друге стране, на нивоу људског тела могуће је добити енергију хемијским распадањем хране.
Енергија сагоревања
На пример, када гориво Метан ЦХ4, најједноставнији угљоводоник, почиње да гори у присуству кисеоничног оксиданса, он ће се распасти, формирајући угљен-диоксид ЦО производе.2 и Вода Х.2ИЛИ. Поред тога, прекидање веза атома водоника са атомима угљеника ослобађаће енергију у облику топлоте.
ЦХ4 (г) + 202 (г) → ЦО2 (г) + 2Х2 О (л) ∆Х = -212,8 Кцал / мол
Једначина сагоревања метана. Топлина ове реакције представљена је са ΔХ. Негативни знак указује на ослобађање Енергије. Реакција је егзотермна.
 Сагоревање метанског гаса. Реакција се манифестује пламеном.
Сагоревање метанског гаса. Реакција се манифестује пламеном.
Примери топлоте сагоревања органских једињења на 25 ° Ц.
Једињење |
Формула |
ΔХ (Кцал / мол) |
Метан (г) |
ЦХ4 |
-212.80 |
Етан (г) |
Ц.2Х.6 |
-372.82 |
Пропан (г) |
Ц.3Х.8 |
-530.60 |
н-бутан (г) |
Ц.4Х.10 |
-687.98 |
н-пентан (г) |
Ц.5Х.12 |
-845.16 |
Етилен (г) |
Ц.2Х.4 |
-337.23 |
Ацетилен (г) |
Ц.2Х.2 |
-310.62 |
Бензен (г) |
Ц.6Х.6 |
-787.20 |
Бензен (л) |
Ц.6Х.6 |
-780.98 |
Толуен (л) |
Ц.7Х.8 |
-934.50 |
Нафтален (и) |
Ц.10Х.8 |
-1,228.18 |
Сахароза (е) |
Ц.12Х.22ИЛИ11 |
-1,348.90 |
Метанол (л) |
ЦХ3Ох |
-173.67 |
Етанол (л) |
Ц.2Х.5Ох |
-326.70 |
Сирћетна киселина (л) |
ЦХ3ЦООХ |
-208.34 |
Бензојева киселина |
Ц.6Х.5ЦООХ |
-771.20 |
Да би гориво обезбедило сву топлоту сагоревања за коју је способно, мора бити у гасовитом стању. Као што се може видети у табели, течни бензен доприноси топлоти сагоревања која је за 6,22 Кцал / мол мања од оне коју ослобађа гасовити бензен. То значи да се за промену течности у гас мора уложити 6,22 Кцал / мол.
Кликните за више информација на Горива.
Електролитска решења Енергија
Електролитички проводник је медијум у коме је укључена једна или више јонских врста, што је распршена са својим електричним набојем, омогућавајући електричној струји да пролази кроз његов Устав. Електролитичка решења су електролитски проводници.
Електролитички проводници поред раствора електролита укључују и: Растопљене соли, а такође и неке чврсте соли, као што су натријум хлорид НаЦл и сребрени нитрат АгНО3.
До преноса електрона долази јонском миграцијом, позитивном и негативном, према електродама. Ова миграција укључује не само пренос електричне енергије, већ и транспорт материје из једног дела проводника у други.
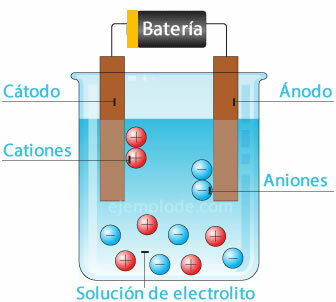 Електрохемијска ћелија
Електрохемијска ћелија
Повезивање потенцијалног извора са металним електродама (катода и анода) и њихово потапање у а Водени раствор, електрони ће путовати кроз аноду, да би побегли из раствора до позитивног пола фонтана. То је случај, на пример, са хлоридним јоном, који се ослобађа од свог електрона, а већ са неутралним наелектрисањем придружује се другом атому хлора, да би формирао двоатомски молекул. Из раствора ће излазити хлорни гас.
2Цл- = 2Цл + 2е-
Електрони који напуштају негативни пол извора биће смештени у потопљеној катоди. Врсте присутне у воденом раствору (јони) узимаће електроне са катоде. На пример, узели су јони водоника који чине воду, будући да су били у позитивном наелектрисању електрон који треба неутралисати и спојити са другим атомом водоника да би се формирао молекул двоатомни. Из раствора ће побећи као водоник.
2Х+ + 2е- = 2Х
2Х = Х2 (г)
Ова размена електрона може подржати рад аутомобилских батерија, које се састоје од оловних Пб електрода уроњених у раствор сумпорне киселине Х2СВ4.
Иста енергија добија се у свим врстама батерија којима се рукује на домаћем нивоу: 9В, АА, ААА, Д, да набројимо неколико примера.
Прехрамбена енергија
Људска бића асимилирају енергију која се ослобађа распадајући храну коју једемо у свом телу. Ову енергију наше тело користи за несвесне функције (варење, откуцаји срца, ћелијске функције) и оне које обављамо.
Све док немате интензивну физичку активност и ваш метаболизам је спор, саветује се редован унос калорија, јер храна богата Сложени липиди и угљени хидрати, који имају веома велике структуре, теже се разграђују, што резултира преокретом Енергија. У том случају ефекат би био тренутно супротан.
Пожељно је конзумирати воће када морате радити ноћу, јер воће садржи фруктозу, једноставан угљени хидрат који се лако разграђује и који ће нам имати на располагању енергију након ваше потрошња.
Хемијска енергија и њене трансформације
Термоелектрична постројења
Тешка горива се користе у термоелектричним постројењима да би имала високу и дуготрајну калоријску вредност. Генерално је то мазут (лож уље). Сагоревање, које је хемијска фаза процеса, служиће као средство за грејање котла, које ће створити засићену пару. Ова пара ће излазити под притиском кроз мрежу за дистрибуцију паре и започиње са померањем турбина генератора. Ови уређаји ће производити електричну енергију за опскрбу одговарајућег становништва.
Хемијска енергија → Механичка енергија → Електрична енергија
Аутомотиве Оператион
Аутомобили зависе од једног извора енергије, а то је батерије. У батерији је већ познато да се јавља електролитска проводљивост која напаја систем паљења, додатну опрему за плочице и помоћне утичнице. Захваљујући овој расположивој електричној енергији, аутомобил ће се моћи кретати да би одвезао возача на жељено место.
Хемијска енергија → Електрична енергија → Механичка енергија